
| A. | NaHX的电离方程式为NaHX═Na++H++X2- | |
| B. | HX-的水解程度大于HX-的电离程度 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-) | |
| D. | 离子浓度关系:c(Na+)>c(HX-)+c(H2X)+c(X2-) |
分析 A.某元素X的酸式盐(NaHX)溶液显碱性,说明阴离子是弱酸阴离子;
B.X的酸式盐(NaHX)溶液显碱性,说明HX-水解大于电离,;
C.由溶液中电荷守恒分析判断;
D.根据物料守恒分析.
解答 解:A.某元素X的酸式盐(NaHX)溶液显碱性,说明阴离子是弱酸阴离子,电离方程式为:NaHX═Na++HX-,故A错误;
B.X的酸式盐(NaHX)溶液显碱性,说明HX-在溶液中以水解为主,即HX-的水解程度大于HX-的电离程度,故B正确;
C.溶液中电荷守恒分析判断,溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),故C错误;
D.NaHX溶液中Na元素与X元素的总浓度相等,即c(Na+)=c(HX-)+c(H2X)+c(X2-),故D错误;
故选B.
点评 本题考查了盐类水解的分析判断,主要是电离和水解影响因素的分析判断,掌握基础是关键,题目较简单,侧重于考查学生对基础知识的应用能力.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 NaCl NaOH | B. | NaOH NaCl Na2CO3 | ||
| C. | NaCl NaOH Na2CO3 | D. | NaCl Na2CO3 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢件表面镀锌时,钢件与外电源的正极相连 | |
| B. | 由反应 (g)+H2(g)→ (g)+H2(g)→ (g)△H=+28.7kJ.mol-1,则环已二烯比苯稳定 (g)△H=+28.7kJ.mol-1,则环已二烯比苯稳定 | |
| C. | 常温时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液pH>7 | |
| D. | 合成氨反应N2+3H2?2NH3,当满足v(N2)逆:v(H2)逆:v(NH3)逆=1:3:2时,标志该反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 试剂 | 方法 |
| A | 分离碘水中的碘 | 乙醇 | 萃取 |
| B | 分离乙酸乙酯和乙醇 | 氢氧化钠溶液 | 分液 |
| C | 除去乙醇中乙酸 | 氧化钙 | 蒸馏 |
| D | 除去乙烷中的乙烯 | 溴的四氯化碳溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. | 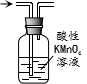 除去甲烷中少量的乙烯得纯净甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①③④⑥ | C. | ②④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-Fe3+ Na+ | B. | Al3+Ba2+HCO3- | C. | K+Na+CO32- | D. | NH4+K+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,如果要合成
,如果要合成 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 2,3-二甲基-1,3-丁二烯和1-丁炔 | B. | 2-甲基-1,3-丁二烯和2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯和乙炔 | D. | 2-甲基-1,3-丁二烯和丙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com