
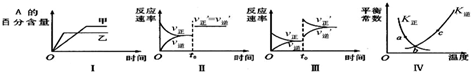
| A、图I表示温度对化学平衡的影响,且甲的温度较高 |
| B、图Ⅱ表示t0时刻缩小容器体积对反应速率的影响 |
| C、图Ⅲ表示t0时刻增大B浓度对反应速率的影响 |
| D、图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清透明的溶液中:Cu2+、K+、SO42-、S2- |
| B、加入苯酚显紫色的溶液:K+、NH4+、Cl-、SCN- |
| C、1.0 mol?L-1的KNO3溶液中:Na+、Fe2+、Cl-、SO42- |
| D、能溶解Al2O3的溶液中:Mg2+、Fe3+、AlO2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3???H++HCO3- HCO3-???H++CO32- | K1=4.31×10-4 K2=5.61×10-11 | |
| C6H5OH | C6H5OH???C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4???H++H2PO4- H2PO4-???H++HPO42- HPO42-???H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3?H2O | NH3?H2O???NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4??Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3???Ba2++CO32- | 2.58×10-9 |
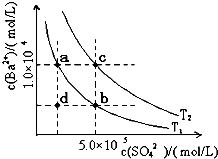 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
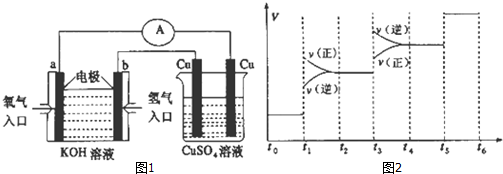
查看答案和解析>>
科目:高中化学 来源: 题型:
A、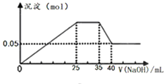 表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2mol?L-1. |
B、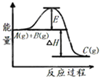 中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时,△H>0,若使用正催化剂,E值会减小. |
C、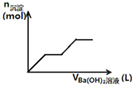 可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
D、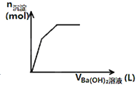 表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:
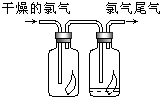 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是查看答案和解析>>
科目:高中化学 来源: 题型:
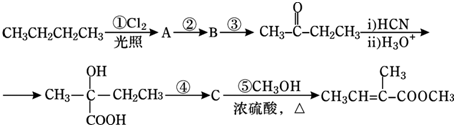
| H3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com