
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
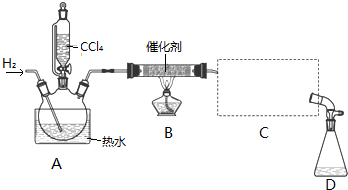
分析 (1)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿;
(2)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢;
(3)蒸馏装置中通常选用直形冷凝管,便于液体流下;冷却水采用逆流的方式冷却效果较好;
(4)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤;
(5)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{实际产量}{理论产量}$×100%计算;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可书写化学方程式.
解答 解:(1)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿,
故答案为:加热时氢气遇氧气发生爆炸、生成的氯仿被氧气氧化;
(2)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢,反应方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl,
故答案为:CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl;
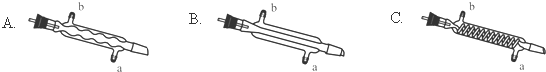
(3)蒸馏装置中通常选用直形冷凝管,便于液体流下,故选B,冷却水采用逆流的方式冷却效果较好,所以冷水应从该冷凝管的a口接入,
故答案为:B;a;
(4)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤,用以洗掉NaHCO3和NaCl,
故答案为:洗掉NaHCO3和NaCl;
(5)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{15g}{24.6g}$×100%=61%,
故答案为:61%;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可知化学方程式为2CHCl3+O2=2COCl2+2HCl,
故答案为:2CHCl3+O2=2COCl2+2HCl.
点评 本题考查了物质制备方案的设计,题目难度中等,涉及仪器的使用、化学实验基本操作方法、化学计算等知识,试题知识点较多、综合性较强,充分考查了学生的化学实验、化学计算能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
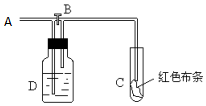 如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )| A. | abc | B. | bcd | C. | abd | D. | abcd |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 浓硫酸是一种重要的化工产品.
浓硫酸是一种重要的化工产品.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
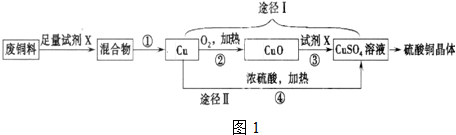

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
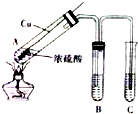
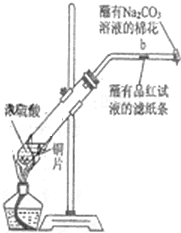 如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:
如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
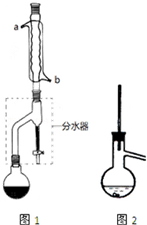 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
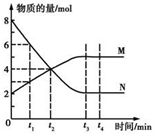
| A. | 反应的化学方程式为2 M?N | |
| B. | t2 min时,正逆反应速率相等,反应达到平衡 | |
| C. | t3 min后,正逆反应仍在进行 | |
| D. | t3~t4 min时,v正(N)=v逆(M) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com