
| A. | 前者 | B. | 后者 | C. | 等于 | D. | 无法确定 |
科目:高中化学 来源: 题型:选择题
 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 有7个碳原子在同一条直线上 | D. | 有5个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
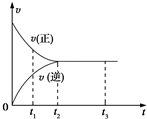 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,V(正)>V(逆) | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,各物质的浓度不再发生变化 | D. | t2~t3,反应不再发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



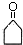 ,G中官能团的名称为酯基、碳碳双键.
,G中官能团的名称为酯基、碳碳双键. +CH3CHO$\stackrel{碱}{→}$
+CH3CHO$\stackrel{碱}{→}$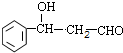 ,反应类型加成反应.
,反应类型加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量的递增而引起的变化 | |
| B. | 元素的化合价呈周期性的变化 | |
| C. | 元素原子核外电子排布呈周期性的变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 供电时的总反应为2H2+O2=2H2O | |
| B. | 负极电极反应为2H2+4OH--4e-=4H2O | |
| C. | 正极电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com