
【题目】如图是甲醇燃料电池的结构示意图。电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法正确的是( )

A.左电极为电池的负极,a处通入的物质是空气
B.右电极为电池的负极,b处通入的物质是甲醇
C.正极反应式为:O2+2H2O-4e-=4OH-
D.负极反应式为:CH3OH+H2O-6e-=CO2+6H+
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a> c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol-1)___________。
(2)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选项中选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用废铁屑(含少量S等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4 ·6H2O](M=392g/mol),设计如图所示装置(夹持仪器略去)。

称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50 ~60°C热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)在实验中选择50~60℃热水浴的原因是___________________。
(2)装置B的作用是_______________________________。
(3)检验制得的(NH4)2SO4·FeSO4·6H2O中是否含有Fe3+的方法:将硫酸亚铁铵晶体用加热煮沸过的蒸馏水溶解,然后滴加________________(填化学式)。
(4)产品中杂质Fe3+的定量
①配制Fe3+浓度为0.1 mg/mL的标准溶液100mL。称取________(精确到0.1)mg高纯度的硫酸铁铵[(NH4)Fe(SO4)2·12H2O],加入20.00 mL经处理的去离子水。振荡溶解后,加入2 mol·L-1HBr溶液1mL和1mol·L-1KSCN溶液0.5mL,加水配成100mL溶液。
②将上述溶液稀释成浓度分别为0.2、1.0、 3.0、5.0、 7.0、 10.0(单位: mg·L-1)的溶液。分别测定不同浓度溶液对光的吸收程度(吸光度),并将测定结果绘制成如图所示曲线。取硫酸亚铁铵产品,按步骤①配得产品硫酸亚铁铵溶液10mL,稀释至100mL,然后测定稀释后溶液的吸光度,两次测得的吸光度分别为0.590、0.610,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_______mg·L-1。

(5)称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用c mol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___________(用含c、V、m的代数式表示,化简)。滴定时,下列滴定方式中,最合理的是___________(填字母)。
A.  B.
B.  C.
C. 
若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果将会_________(填“偏大”“偏小”或“无影响”。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理、回收利用CO是环境科学家研究的热点课题。回答下列问题:
Ⅰ.处理大气污染物
CO用于处理大气污染物N2O所发生的反应原理为:![]()
![]() 有人提出上述反应可以用“Fe+”作催化剂。
有人提出上述反应可以用“Fe+”作催化剂。
其总反应分两步进行:(1)第一步:![]() ;第二步:____ (写反应方程式)。
;第二步:____ (写反应方程式)。
(2)第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率____ 第一步反应速率(填“大于”“小于”或“等于”)。
Ⅱ.合成天然气(SNG)涉及的主要反应原理如下:
CO甲烷化: ![]()
![]()
水煤气变换: ![]()
![]()
(3)反应![]() 的△H= ___kJ/mol。
的△H= ___kJ/mol。
(4)在一恒容容器中,按照nmolCO和3nmolH2投料发生CO甲烷化反应,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,下列说法正确的是_____(填标号)。

a.温度:T1<T2<T3
b.正反应速率:v(e)>v(c)>v(b)
c.平衡常数:K(a)<K(d)<K(c)
d.平均摩尔质量:M(a)>M(b)=M(e)
(5)在恒压管道反应器中,按n(H2)︰n(CO)=3︰1通入原料气发生CO甲烷化反应,400℃、P总为100kPa时反应体系平衡组成如下表所示。
组分 | H2 | CO | CH4 | H2O | CO2 |
体积分数 | 8.50 | 1.50 | 45.0 | 44.0 | 1.00 |
则该条件下CO的总转化率α= ___。 (保留一位小数)
(6)将制备的CH4用来组成下图所示燃料电池电解制备N2O5

①阳极的电极反应为_____。
②理论上制备1molN2O5,石墨2电极消耗气体的体积为_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=___kJ·mol-1。
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___。
N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___。
a.使用催化剂 b.降低温度 c.及时分离水
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:

①外电路电子移动方向:___。(填“a极到b极”或“b极到a极”)。
②a极电极反应式为___。
③若燃料电池消耗的空气在标准状况下的体积是22.4L(假设空气中O2体积分数为20%),则理论上消耗甲烷___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经如图所示路线合成:
是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经如图所示路线合成:
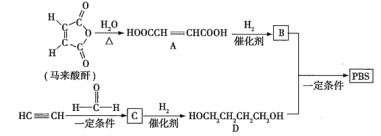
已知: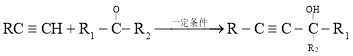 。
。
(1)![]() 的反应类型是___________;
的反应类型是___________;![]() 的结构简式是___________________。
的结构简式是___________________。
(2)![]() 中含有的官能团的名称是______________;
中含有的官能团的名称是______________;![]() 的名称(按系统命名法)是___________________。
的名称(按系统命名法)是___________________。
(3)半方酸是马来酸酐的同分异构体,分子中含有1个环(四元碳环)和1个羟基,但不含![]() 结构,半方酸的结构简式是_____________________。
结构,半方酸的结构简式是_____________________。
(4)由![]() 和
和![]() 合成
合成![]() 的化学方程式是____________________________。
的化学方程式是____________________________。
(5)下列关于![]() 的说法正确的有_____________(填序号)。
的说法正确的有_____________(填序号)。
a.能使酸性![]() 溶液、溴的
溶液、溴的![]() 溶液褪色
溶液褪色
b.能与![]() 溶液反应,但不与
溶液反应,但不与![]() 反应
反应
c.能与新制![]() 悬浊液反应
悬浊液反应
d.![]() 完全燃烧消耗
完全燃烧消耗![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1.00L浓度均为0.0100mol/L的Na2SO3、NaOH 混合溶液中通入HCl气体调节溶液pH(忽略溶液体积变化)。其中比H2SO3、HSO3-、SO32-平衡时的分布系数(各含硫物种的浓度与含硫物种总浓度的比)随HCl气体体积(标况下)的变化关系如图所示(忽略SO2气体的逸出);已知Ka1代表H2SO3在该实验条件下的一级电离常数。下列说法正确的是
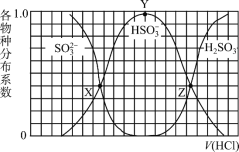
A.Z点处的pH=-lgKa1(H2SO3)
B.从X点到Y点发生的主要反应为SO32- +H2OHSO3- +OH-
C.当V(HCl)≥672mL时,c(HSO3-) = c(SO32-)=0mol/L
D.若将HCl改为NO2,Y点对应位置不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com