
A. 时 时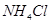 溶液的KW大于 溶液的KW大于 时 时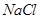 溶液的KW 溶液的KW |
B.SO2通入碘水中,反应离子方程式为 |
C.加入铝粉能产生H2的溶液中,可能存在大量的 |
D. 时,将pH=2的盐酸与pH=12的 时,将pH=2的盐酸与pH=12的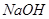 溶液等体积混合,溶液显中性 溶液等体积混合,溶液显中性 |
科目:高中化学 来源:不详 题型:实验题
 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同)。试回答:
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同)。试回答:
 (1)此实验中,观察到的现象有:
(1)此实验中,观察到的现象有:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.根据反应 可知:用酸性KMnO4溶液可检验绿矾 可知:用酸性KMnO4溶液可检验绿矾 是否变质 是否变质 |
B.根据反应 可知:反应中HNO3表现酸性和氧化性 可知:反应中HNO3表现酸性和氧化性 |
C.根据反应 可知: 可知: 的酸性比 的酸性比 强 强 |
D.根据反应 可知: 可知: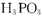 属于三元酸 属于三元酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④ | B.①② | C.①②③④ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.硫酸氢铵和氢氧化钠等物质的量混合: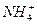 +OH-====NH3↑+H2O +OH-====NH3↑+H2O |
B.碳酸钙与醋酸的反应: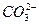 +2H+====CO2↑+H2O +2H+====CO2↑+H2O |
C.水玻璃与过量稀硝酸反应: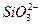 +2H+====H2SiO3↓ +2H+====H2SiO3↓ |
| D.氯气与氢氧化钠溶液反应:Cl2+2OH-====Cl-+HClO+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 D、E各为何种物质,写出它们的化学式。(5分)
D、E各为何种物质,写出它们的化学式。(5分)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子的物质的量相等 | B.微粒的总的数量应相等 |
| C.正电荷和负电荷总数应相等 | D.电荷量和各元素原子的物质的量应相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com