
金属钼(Mo)可以增强合金的某些机械性能和耐腐蚀性。下图是化工生产中制备金属钼的实验流程图(已知钼酸为难溶于水和酸的黄色晶体):

(1)在灼烧钼矿时发生化学反应:2MoS2+7O2 2MoO3+4SO2,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为______________。
2MoO3+4SO2,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为______________。
(2)步骤①中,灼烧钼矿时,用于盛放固体的仪器的名称为______________。
(3)写出步骤②中发生反应的离子方程式______________________________。
(4)在步骤③中需要加入过量硝酸,检验硝酸过量的操作为_________________。
(5)某同学拟选用如下装置,用氢气还原三氧化钼,同时检验该反应的氧化产物,根据要求回答下列问题。
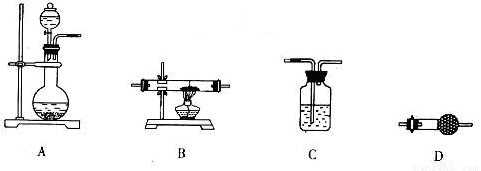
①若两次使用到C装置,则装置D中所盛的药品是___________(填试剂名称)。
②根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞后_________→_________→_________→_________(请按正确的顺序填入下列步骤的代号)。
a.收集气体并检验其纯度 b.停止加热,充分冷却
c.加热反应一段时间 d.关闭分液漏斗活塞,停止通氢气
(6)化学分析中,常用沉淀法测定金属的含量。若称取三氧化钼粗产品m g,用浓氨水溶解后,再滴加足量的硝酸使其完全转化为钼酸沉淀,此时消耗0.2 mol/L HNO3溶液250mL ,则粗产品中三氧化钼的含量为 (请用含m的表达式表示)。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2015-2016学年辽宁省高二上学期期中测试化学试卷(解析版) 题型:选择题
将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是:
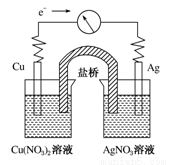
A、KNO3盐桥中的K+移向Cu(NO3)2溶液
B、Cu作负极,发生还原反应
C、电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液
D、工作一段时间后,AgNO3溶液中c(Ag+)减小
查看答案和解析>>
科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:填空题
K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6] 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
(1)K4[Fe(CN)6]中Fe2+的配位数为 (填数字);Fe2+基态核外电子排布式为 。
(2)(CN)2分子中碳原子杂化轨道类型为 ;1mol(CN)2分子中含有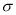 键的数目为 。
键的数目为 。
(3)O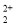 与CN
与CN 互为等电子体,则O
互为等电子体,则O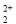 的电子式为 。
的电子式为 。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上一次月考化学试卷(解析版) 题型:选择题
下列有关滴定操作的顺序正确的是
①用标准溶液润洗滴定管;②往滴定管内注入标准溶液
③检查滴定管是否漏水;④滴定; ⑤洗涤
A、⑤①②③④ B、③⑤①②④ C、⑤②③①④ D、②①③⑤④
查看答案和解析>>
科目:高中化学 来源:2016届江西省高安市高三上学期第二次段考化学试卷(解析版) 题型:填空题
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式___ _____。
(2)已知:Se + 2H2SO4(浓) → 2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O → Se + 2SO42- + 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目________________________________。
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期10月阶段性教学质检化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有4个电子,Y是地壳中含量最高的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
A.X、Y、Z、W四种元素的最外层电子数之和为18
B.原子半径由大到小的顺序:W>Z>Y>X
C.单质的熔点:W>Z
D.简单气态氢化物的稳定性:X>Y>W
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列物质分类的正确组合是
选项 | 碱 | 酸 | 盐 | 酸性氧化物 |
A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
C | 氨水 | 醋酸 | 石灰石 | 水 |
D | 苛性钾 | 碳酸 | 胆矾 | 三氧化硫 |
查看答案和解析>>
科目:高中化学 来源:2016届浙江省新安江校区高三上学期第二次模拟化学试卷(解析版) 题型:选择题
某实验过程如图所示,则图③试管中的现象是

A.铜片溶解,产生无色气体,该气体遇空气变为红棕色
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.无明显现象,因稀硫酸不与铜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com