
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
【答案】A
【解析】
若开始时只充入2mol E(g),达到的平衡与开始时充入2mol M和1mol N的混合气体,达到的平衡等效;在这两个平衡中,各物质的百分含量即各物质的质量百分含量,各物质的物质的量的百分含量,各气体的体积百分含量,物质的量,物质的质量,各气体的体积,各物质的物质的量,浓度和物质的转化率均完全相同。
只充入2mol E(g),E的转化率为40%,设E转化了2x
则有 2M(g) + N(g) ![]() 2E(g)
2E(g)
始(mol) 0 0 2
转(mol) 2x x 2x
平(mol) 2x x 2-2x
![]() x=0.4mol
x=0.4mol
达到平衡时气体总物质的量为2.4mol,若开始时充入2mol M、1mol N时,平衡等效,平衡时气体总物质的量也为2.4mol,在密闭容器中,压强之比等于物质的量之比,那么达平衡时混合气体的压强比起始时减少了![]() =20%;答案选A。
=20%;答案选A。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应![]() ,达平衡后,温度一定时,将气体体积缩小到原来的
,达平衡后,温度一定时,将气体体积缩小到原来的![]() ,当达新平衡时,C的浓度为原来的
,当达新平衡时,C的浓度为原来的![]() 倍,则下列推断正确的是
倍,则下列推断正确的是![]()
A.平衡向正向移动了
B.![]()
C.达新平衡时,A的浓度小于原平衡A浓度的2倍
D.达新平衡时,容器内总压一定比原平衡的2倍小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn2O3是一种重要的工业原料,在电磁和有机合成等领域应用广泛。某学习小组在实验室用CH4还原MnO2制备Mn2O3,并测定产品纯度。请回答下列问题:
Ⅰ.制备(实验装置如图所示)

已知:Al4C3+12H2O==4Al(OH)3+3CH4↑。
(1)仪器a的名称为______________________
(2)连接好实验装置,检验装置的气密性并加入相应试剂。向烧瓶中滴加稀醋酸之后,在点燃酒精灯之前应进行的操作是____
(3)仪器b中同时生成两种能参与大气循环的物质,该反应的化学方程式为_______
Ⅱ.测定产品中Mn2O3的纯度(只考虑产品中混有少量未参与反应的MnO2)
ⅰ.实验结束后,取仪器b中所得固体7.19g,加入足量硫酸酸化的KI溶液,使固体中锰元素全部转化为Mn2+;(步骤ⅰ中发生反应的离子方程式为:Mn2O3+2I- +6H+==2Mn2++ I2+ 3H2O MnO2+2I- + 4H+==Mn2++ I2+ 2H2O )
ⅱ.将所得溶液稀释至500mL;
ⅲ.取25.00mL稀释后的溶液,滴加几滴淀粉溶液,用0.200molL-1的Na2S2O3标准溶液滴定,达到滴定终点时,消耗25.00mLNa2S2O3标准溶液。
(已知:I2+2 Na2S2O3==Na2S4O6+2NaI)
(4)滴定终点的标志是__________________________
(5)所取固体中Mn2O3的质量分数为___________________(计算结果精确到0.1%)
(6)下列操作使测定结果偏高的是______________
A.滴定前平视,滴定终点俯视读数
B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗
C.硫酸酸化的KI溶液在空气中静置时间过长
D.滴定前正常,滴定后滴定管尖嘴内有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的单质、化合物在生产生活中有广泛应用。
(1)石墨是碳的一种单质。
已知:
C(石墨)+![]() O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
则C(石墨)+H2O(g)=CO(g)+H2(g)△H=___kJ·mol-1
②以石墨为电极电解饱和食盐水,阳极的电极反应式是___。
(2)利用CO2生产甲醇:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.0kJ·mol-l
往密闭容器中充入CO2和H2,在一定条件下反应,CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
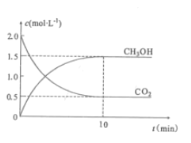
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol.L-1.min-1。
②达到平衡后,改变下列条件,能使化学平衡向正反应方向移动的是____(填标号)。
A.升高温度 B.再充入一定量的CO2 C.减小压强
(3)醋酸是常见的弱酸。
①往CH3COOH溶液中加入同体积、同浓度的氨水混合溶液的导电性___(填“增强”或“减弱“)。
②25℃时,往CH3COOH溶液中加入NaOH溶液,当c(CH3COO-)=(Na+)时,溶液pH___7(填“或“<")
(4)碳酸钠是一种重要碳酸盐。
①往0.1mol·L-1的Na2CO3溶液中滴入几滴酚酞试液,溶液呈现___色,原因是___(用离子方程式表示)。
②Na2CO3溶液可将锅炉水垢中的CaSO4转化为易除去的CaCO3:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(ag),25℃时该反应的平衡常数为___。[Ksp(CaCO3)=5.0×10-9,Ksp(CaSO4)=7.1×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在容积不变的密闭容器中发生反应X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min时浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.平衡后,增大体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c (A)(mol/L) | 1.45 | 1.28 | 1.00 | 1.00 |
c (B)(mol/L) | 0.38 | 0.72 | 1.28 | 1.28 |
c (C)(mol/L) | 0.095 | 0.18 | 0.32 | 0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图示与对应的叙述相符的是![]()

A.图甲表示在恒容密闭容器中,恒温条件下发生的可逆反应![]() ,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
B.图乙曲线表示反应![]() ,正、逆反应的平衡常数K随温度的变化
,正、逆反应的平衡常数K随温度的变化
C.图丙表示对反应![]() 在
在![]() 时刻增大压强
时刻增大压强
D.图丁表示反应![]() :
:![]() ;
;![]() ;
;![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3是制造有机磷农药和磺胺嘧啶类医药的原料,其制备方法是将熔融黄磷(P4)与干燥氯气进行氯化反应。
(1) PCl3遇水会强烈水解,写出PCl3与水反应的化学方程式:________。
(2) 制得的PCl3粗产品中常含有POCl3、PCl5等杂质。通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):
a. 迅速移取20.00 g PCl3粗产品,加水完全水解后,再配成500.00 mL溶液;
b. 量取所配溶液25.00 mL于碘量瓶中,加入0.500 0 mol·L-1碘溶液20.00 mL和1.000 mol·L-1(NH4)3BO3溶液30.00 mL,振荡;
c. 加入2~3滴淀粉溶液,用1.000 0 mol·L-1 Na2S2O3标准溶液滴定过量的碘,滴至终点时消耗Na2S2O3标准溶液12.00 mL。
已知测定过程中的部分反应为H3PO3+H2O+I2![]() H3PO4+2HI,3HI+(NH4)3BO3===3NH4I+H3BO3,I2+Na2S2O3―→Na2S4O6+NaI(未配平)。
H3PO4+2HI,3HI+(NH4)3BO3===3NH4I+H3BO3,I2+Na2S2O3―→Na2S4O6+NaI(未配平)。
①步骤b中加入(NH4)3BO3溶液的目的是________。
②判断步骤c中滴定终点的方法为________。
③根据上述数据,计算制得粗产品中PCl3的质量分数(写出计算过程)。_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com