
【题目】以下X、Y、Z、W、R五种元素均为短周期元素,它们的化合价与原子序数的关系如图,下列说法正确

A.简单离子的半径: Y>Z>X
B.最高价氧化物对应水化物的酸性: R>W
C.单质的还原性: Z>Y
D.简单氢化物的沸点: W>X
【答案】B
【解析】
根据原子序数与最高正价、最低负价,X无最高正价,只有最低负价-2,则X为O;Y的最高正价为+1,且原子序数比O大,可知Y为Na;同样的方法,可知Z为Al,W为S、R为Cl。
根据分析,X为O,Y为Na,Z为Al,W为S,R为Cl。
A.X、Y、Z形成的简单离子分别为O2-、Na+、Al3+,它们的核外电子排布相同。当核外电子排布相同时,核电荷数越大,半径越小,则简单离子的半径X(O2-)>Y(Na+) >Z(Al3+),A错误;
B.非金属元素的非金属性越强,其最高价氧化物的水化物的酸性越强。同周期的非金属元素,其非金属性从左到右依次增强,则最高级氧化物对应的水化物的酸性R(HClO4)>W(H2SO4),B正确;
C.金属的金属性越强,其单质的还原性越强。同周期元素的金属元素,从左到右依次减弱,则单质的还原性:Y(Na)>Z(Al),C错误;
D.X形成的简单氢化物H2O,能够形成氢键,使得沸点升高,则简单氢化物的沸点X(H2O)>W(H2S),D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】常温下,对于①![]()
![]() 溶液②
溶液②![]() 的HCl溶液③
的HCl溶液③![]() 的NaOH溶液④
的NaOH溶液④![]()
![]() 溶液,下列说法正确的是
溶液,下列说法正确的是![]()
A.①和②分别稀释100倍后的pH:②<①
B.水电离出的![]() :④>③>②>①
:④>③>②>①
C.①和③混合后溶液呈中性: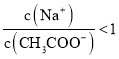
D.①和④混合后溶液呈酸性: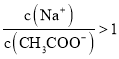
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯乙烯(PS)和聚对苯二甲酸乙二醇酯(PET)材料具有高韧性、质轻、耐酸碱等性能,在生产生活中应用广泛。这两种聚合物可按下图路线合成,请回答下列问题:

(1)A的分子式为______,其核磁共振氢谱有______组(个)吸收峰。
(2)含有苯环的B的同分异构体有______种。
(3)D为苯乙烯,其结构简式为______,官能团为______。
(4)F的名称为______,由E→G的反应类型是______(填“缩聚”或“加聚”)反应。
(5)已知:
![]()
![]()
![]()
![]()
![]()
写出由BrCH2CH2Br制备HOOC-CH2CH2-COOH的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol碳正离子(CH3+)所含的电子总数为9NA
B.25℃,pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA
C.常温常压下,过氧化钠与水反应时,生成8g氧气转移的电子数为0.5NA
D.1mol雄黄(As4S4),结构如图:![]() ,含有2NA个S-S键
,含有2NA个S-S键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:

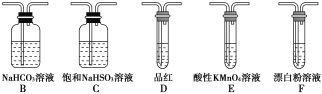
(1)装置A中反应的化学方程式为______________________________________。
(2)使分液漏斗中液体顺利流下的操作是_________________________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是_________
②丙同学设计的合理实验方案为A→C→________→________→D→F,其中装置C的作用是______,证明亚硫酸的酸性强于次氯酸的实验现象是____________
(4)K2S2O8具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_________,称取0.250 0 g 产品于碘量瓶中,加100 mL水溶解,再加入8.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用 c mol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液V mL,则样品中K2S2O8的纯度为________%(用含c、V的代数式表示,已知:S2O82-+2I-===2SO42-+I2 ;2S2O32-+I2===2S4O82-+2I- )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molNa2O2与SO2完全反应,转移2NA个电子
B. 标准状况下,11.2L乙醇中含有的极性共价键数目为3.5NA
C. 18g的D2O中含有的中子数为10NA
D. 1L0.1mol·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B.标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA
C.0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA
D.加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,请回答下列问题:
常温下,某Na2CO3溶液中滴入酚酞,溶液呈_____色,则该溶液呈 ______ 性,原因是 ______(用离子方程式表示),若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是_________,
(2)已知在H2S溶液中存在下列平衡:H2S![]() HS- + H+
HS- + H+
①向H2S溶液中加入NaOH固体时(不考虑温度变化),电离平衡向 ______ 移动(填“左”或“右”)![]() ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
②向H2S溶液中加入NaHS固体时,电离平衡向______ 移动(填“左”或“右”),pH ______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为几种化合物的元素组成示意图,以下说法错误的是

A. 若①为某种具有催化作用的化合物,则其水解产物为氨基酸
B. 若②为脂肪,则其大量积累于皮下和内脏器官周围
C. 若③为蓝藻的遗传物质,则其和蛋白质组成染色体
D. 若④为糖原,则其主要分布在人和动物的肌肉和肝脏中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com