
| A、12 mo1 |
| B、15 mo1 |
| C、16 mo1 |
| D、17 mo1 |
| 144g |
| 72g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
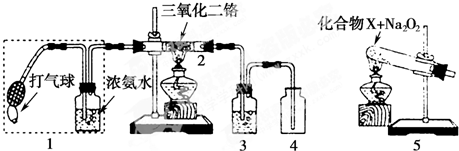
查看答案和解析>>
科目:高中化学 来源: 题型:
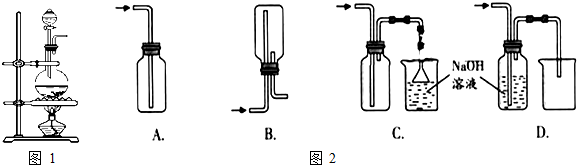
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去铁粉中混有少量铝粉,可加入过量的稀硫酸溶液,完全反应后过滤 |
| B、为测定熔融氢氧化钠的导电性,不能在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C、制备Fe(OH)3胶体,通常是将NaOH溶液滴入FeCl3溶液中 |
| D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、被马蜂(其体内分泌物含蚁酸,呈酸性)蜇过的部位,涂些肥皂水可减轻红肿、疼痛 |
| B、误食重金属盐者,立即喝足量牛奶或豆浆或鸡蛋清以紧急解毒 |
| C、锅里油失火时,立即甲油泼掉或加水浇灭 |
| D、酒精灯着火,应立即有湿抹布覆盖酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
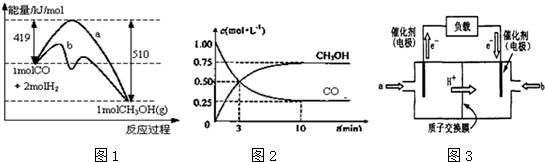
| 物质 | CO | H2 | CH3OH |
| 浓度/(mol?L-1) | 0.1 | 0.2 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是黏土、石灰石、石膏的混合物 |
| B、水泥、沙子和水的混合物成为水泥沙浆 |
| C、水泥、沙子和碎石的混合物称为混凝土 |
| D、水泥和水混合搅拌后很容易凝固变硬具有水硬性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com