
| A. |  长颈漏斗 | B. |  表面皿 | C. |  三脚架 | D. | 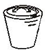 瓷钳锅 |
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入3mol H2和1molN2,充分反应后可得到NH3分子数为2NA | |
| B. | 0.1mol/L Na2SO4溶液中含有Na+为0.2NA | |
| C. | 一定条件下,23 g Na与O2反应生成Na2O2时失去的电子数为NA | |
| D. | 标准状况下,22.4L SO3中含有的氯原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以为单位1L 该气体的质量 | B. | 以“克”为单位,VL该气体的质量 | ||
| C. | 1L该气体中所含的分子数 | D. | 以“升”为单位 1mol该气体的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与NaOH反应的氯气一定为0.3 mol | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.3<n<0.5 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、甲苯 | B. | 乙炔、苯乙烯 | C. | 甲醛、甲酸甲酯 | D. | 甲烷、辛醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有 18 个族 | |
| B. | 1-20 号元素称为短周期元素 | |
| C. | 元素周期表中有 7 个主族,7 个副族 | |
| D. | 零族元素原子最外层均为 8 个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com