
| ||
| ||
| ||
| ||
| ||
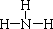 ����������������������Һ��Ӧ�Ļ�ѧ����ʽΪAlN+NaOH+H2O=NaAlO2+NH3������֤��Һ�������ʵ�ʵ�鷽��Ϊȡ������Һ�����Թ��У���μ���ϡ���ᣬ���Ȳ�����ɫ��������ʧ��˵��ΪNaAlO2��
����������������������Һ��Ӧ�Ļ�ѧ����ʽΪAlN+NaOH+H2O=NaAlO2+NH3������֤��Һ�������ʵ�ʵ�鷽��Ϊȡ������Һ�����Թ��У���μ���ϡ���ᣬ���Ȳ�����ɫ��������ʧ��˵��ΪNaAlO2��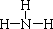 ��AlN+NaOH+H2O=NaAlO2+NH3����ȡ������Һ�����Թ��У���μ���ϡ���ᣬ���Ȳ�����ɫ��������ʧ��˵��ΪNaAlO2��
��AlN+NaOH+H2O=NaAlO2+NH3����ȡ������Һ�����Թ��У���μ���ϡ���ᣬ���Ȳ�����ɫ��������ʧ��˵��ΪNaAlO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Ũ�������Ҳ������ˮCaCl2���� |
| B��NH3�ǵ���ʣ�����ˮ�ܵ��� |
| C��NH3����ʹ����ĺ�ɫʯ����ֽ���� |
D��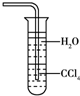 ��ˮ����NH3����ͼװ�ÿɷ�ֹ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���� | B���٢� | C���٢ڢ� | D���ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
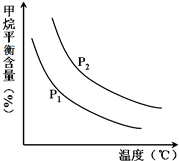 ���Ĺ̶���ָ����Ԫ��������̬ת��Ϊ����̬�Ĺ��̣��ݱ��������¡���ѹ�����������£�N2�ڲ��������������Ķ������Ѵ�����������ˮ������Ӧ�����ɵ���Ҫ����ΪNH3����Ӧ���Ȼ�ѧ����ʽΪ��2N2��g��+6H2O��l��?4NH3��g��+3O2��g����H=+1530.0kJ/mol��Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2��g��+3H2��g��?2NH3��g����H=-93.0kJ/mol��
���Ĺ̶���ָ����Ԫ��������̬ת��Ϊ����̬�Ĺ��̣��ݱ��������¡���ѹ�����������£�N2�ڲ��������������Ķ������Ѵ�����������ˮ������Ӧ�����ɵ���Ҫ����ΪNH3����Ӧ���Ȼ�ѧ����ʽΪ��2N2��g��+6H2O��l��?4NH3��g��+3O2��g����H=+1530.0kJ/mol��Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2��g��+3H2��g��?2NH3��g����H=-93.0kJ/mol��| n(H2O) |
| n(CH4) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��BA |
| B��BA2 |
| C��B2A2 |
| D��A2B2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com