
将下列物质按酸、碱、盐分类依次排列正确的是
A.硫酸、纯碱、石灰石 B.氢硫酸、烧碱、绿矾
C.石炭酸、熟石膏、醋酸钠 D.磷酸、乙醇钠、苛性钾
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:实验题
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。

【背景素材】
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO3-, MnO4-被还原成Mn2+
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1)装置A三颈烧瓶中发生反应的化学方程式为_______________________。
(2)B装置的目的是①________________②_____________。
(3)E装置的作用是 。
【测定NaNO2纯度】
(4)本小题可供选择的试剂有:
A.稀硫酸
B.c1mol/LKI溶液
C.淀粉溶液
D.c2mol/LNa2S2O3溶液
E.c3mol/L酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列有关氮元索及其化合物的表示正确的是
A. 质子数为7、中子数为7的氮原子:147N
B. 氮原子的结构示意图:
C. 氨气分子的电子式:
D. 对硝基甲苯的结构简式: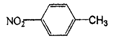
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
由C16O和C18O组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是
A.混合气体中C16O与C18O的分子数之比为14:15
B.混合气体中C16O与C18O的物质的量之比为1:1
C.混合气体中C16O与C18O的质量之比为15:14
D.混合气体中C16O与C18O的密度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

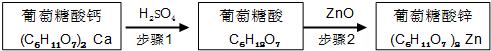
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
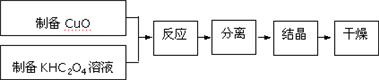
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com