
【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2![]() 2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/molL﹣1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
① H2O2的分解反应________氧化还原反应(填“是”或“不是”).
②该分解反应0─20min的平均反应速率v(H2O2)为________molL﹣1 min﹣1 .
③如果反应所用的H2O2溶液为100mL,则共产生O2________g.
A.0.08 B.0.16 C.1.28 D.2.4.
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界__________。
(2)表中最活泼的金属与最活泼的非金属形成的物质是__________________(填化学式)。
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_________________________________________________________________________________,这两种化合物中所含的化学键有________(填字母)。
A 极性共价键 B 非极性共价键 C 离子键
(4)e、f、k、m对应的单原子离子的半径由大到小的顺序为__________(填离子符号)。
(5)d、m对应的离子还原性由强到弱顺序为___________________________________(填离子符号)。
(6)d、e、m的气态氢化物中,最不稳定的是________________________(填分子式)。
(7)用电子式表示n与m形成的原子个数比2∶1的化合物的形成过程:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲检验集气瓶中是否收集满SO2气体,则置于瓶口的滤纸应蘸有的溶液是( )
A.BaCl2溶液B.酸性KMnO4溶液
C.KI淀粉溶液D.澄清的石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I彩色水泥墙含氯化亚钴可作睛雨表。下表为几种氯化亚钻的晶体颜色:
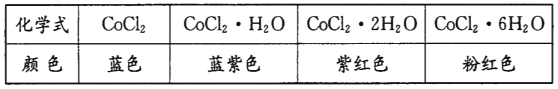
淋雨时彩色水泥墙的颜色为________。
Ⅱ从含钻废料(含CoO、Co2O3及金属Al、Li)中制取粗CoO的流程如下:

(1)步骤I产生的气体是________ (填化学式,下同),从含铝溶液中沉淀铝可通入的气体是________。
(2)步骤Ⅲ中除去A13+的离子方程式为________,步骤Ⅳ中Na2CO3溶液的作用是________(用离子方程式表示)。
(3)为了获得高纯度的钴粉,从环保角度考虑,还原Co2O3的试剂为________ (填序号)。
A.铝 B.木炭 C氢气 D.一氧化碳
(4)实验室制备氯化亚钴晶体并测其化学式的流程如下:

①步骤Ⅱ“系列操作”中洗涤晶体不用蒸馏水而用酒精,目的是________。
②用灼烧一称重法测定氯化亚钴晶体中结晶水含量时,需要在氯化氢氛围中灼烧结晶水合物,请结合方程式解释这样做的原因________。
③已知几种物质在20℃时的Ksp如下表:

某同学用滴定法测定晶体CoCl2·xH2O中的x,常用标准硝酸银法进行滴定,滴定时选择的指示剂是________(填编号)。
A KCl B KSCN C K2S D K2CrO4
若取样品ag溶于蒸馏水中配制100mL溶液取20mL配制溶液于锥形瓶中,加入所选指示剂,用c mol / L AgNO3溶液滴定至终点消耗标准溶液bmL,则x的表达式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查尔酮是一种能制备抗炎药物的化工原料。其中一种合成路线如下:

(1)B的名称为_________;查尔酮含有的含氧官能团名称是_________。
(2)A→B的反应类型是_________;C的结构简式为_________。
(3)写出E→F的化学方程式_________。
(4)F的同分异构体中,含有![]() 结构且水解产物为芳香醇的酯共有种_________,其中核磁共振氢谱吸收峰最少的分子结构简式为_________。
结构且水解产物为芳香醇的酯共有种_________,其中核磁共振氢谱吸收峰最少的分子结构简式为_________。
(5)已知: 。参照上述流程,以CH2=CH-CH3为原料合成
。参照上述流程,以CH2=CH-CH3为原料合成  ,设计最简合成路线。_______________
,设计最简合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学反应方程式正确且能设计成原电池的是_________。
A.KOH + HCl = KCl + H2O B. Cu + Fe3+ = Fe2+ + Cu2+
C.Na2O + H2O = 2NaOH D.Fe + H2SO4 = FeSO4 + H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。有关实验现象,下列说法正确的是:______。
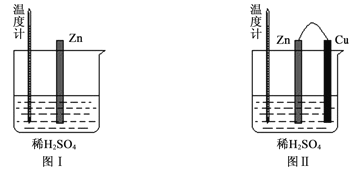
A.图I中温度计的示数高于图II的示数
B.图I和图II中温度计的示数相等,且均高于室温
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速度比I慢
(3)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O
①写出放电时正极的电极反应式:___________;
②铅蓄电池放电时,负极质量将_______(填“增大”、“减小”或“不变”)。当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,是原电池的装置图。请回答:
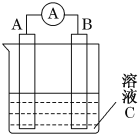
若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为______;电子的移动方向是______________;反应进行一段时间后溶液C的氢离子浓度将________(填“升高”、“降低”或“基本不变”)。
(2)下图是一个双液原电池装置图,下列说法正确的是__________。
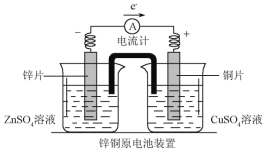
A.盐桥中的阴离子向CuSO4溶液中移动 B.盐桥的作用之一是平衡电荷
C.铜片作电池的负极 D.该电池比单液原电池的电流更稳定
(3)甲醇是重要的化工原料,又可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
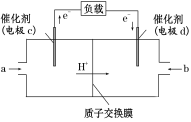
电池总反应为2CH3OH+3O2===2CO2+4H2O,则C电极是________(填“正极”或“负极”),C电极的反应方程式为_______________;若线路中转移3 mol电子,则上述CH3OH燃料电池,消耗的CH3OH的质量为_____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com