
【题目】单质铝应用极为广泛,从铝土矿中提取铝主要分以下三个阶段,根据要求回答相关问题
(1)铝土矿的提纯:铝土矿主要成分是Al2O3(含有Fe2O3、SiO2等杂质),提纯流程如下图所示:
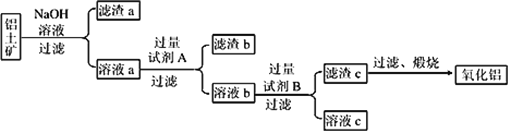
①在用NaOH溶液母液浸提过程中需研碎、湿磨,其目的是______________________________。
②向溶液a中通入过量CO2,所得不溶物煅烧后也可得Al2O3,该方法的缺点是___________________________________________________。
(2)制备无水氯化铝
其反应为:2Al2O3+6Cl2![]() 4AlCl3+O2
4AlCl3+O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是_____________________________。
(3)电解制取铝
目前可低温电解AlCl3熔盐得到金属铝纯的无水氯化铝熔点190℃,沸点180℃,其导电性如图:
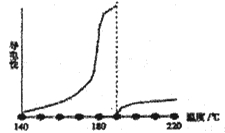
①从图中可知,AlCl3熔融液导电能力___________________________。
②但若在AlCl3中加入NaCl,使形成共融物,将AlCl3制成离子型液体,导电能力增强,熔融液中存在的阴离子是Cl-、AlCl4-、Al2Cl7-,请写AlCl3加入NaCl后形成离子型液体的两个离子方程式:AlCl3+ Cl-=AlCl4-、及平衡________________________________。
③电解时,阳极主要是AlCl4-放电,其电极反应为__________________________________。
④为保证电解进行,熔融液主要离子是AlCl4-、Al2Cl7-,则n(AlCl3)∶n(NaCl)应大于________。
【答案】 增大接触面积,加快反应速率 会使制得的Al2O3中混有SiO2杂质 焦炭与反应产生的O2产生CO2和CO,使O2浓度降低,平衡向右移动,提高转化率 导电能力差,无法电解产生铝单质 2A1Cl4-![]() Al2Cl7-+ Cl- 4 A1Cl4--2e-=2Al2Cl7-+Cl2↑ 3∶2
Al2Cl7-+ Cl- 4 A1Cl4--2e-=2Al2Cl7-+Cl2↑ 3∶2
【解析】试题分析:(1)①研碎、湿磨,能增大接触面积;②a溶液含有NaAlO2、Na2SiO3, NaAlO2、Na2SiO3与CO2反应生成氢氧化铝沉淀、硅酸沉淀;(2)③加入焦炭,与反应产生的O2产生CO2和CO;(3)①无水氯化铝熔点190℃,根据图示,大于190℃时,熔融液导电能力差;②根据电荷守恒、元素守恒书写Cl-、AlCl4-、Al2Cl7-体系中的离子方程式;③电解时,阳极是AlCl4-放电生成Al2Cl7-和氯气;④根据电解总反应![]() ,实质是电解氯化铝;
,实质是电解氯化铝;
解析:(1)①研碎、湿磨,能增大接触面积,加快反应速率;②a溶液含有NaAlO2、Na2SiO3, NaAlO2、Na2SiO3与CO2反应生成氢氧化铝沉淀、硅酸沉淀,灼烧氢氧化铝、硅酸生成Al2O3、SiO2,所以缺点是制得的Al2O3中混有SiO2杂质;(2)③加入焦炭,与反应产生的O2产生CO2和CO,使2Al2O3+6Cl2![]() 4AlCl3+O2,使O2浓度降低,平衡向右移动,提高转化率,所以实际生产中需加入焦炭;(3)①无水氯化铝熔点190℃,根据图示,大于190℃时,熔融液导电能力差,所以无法电解产生铝单质;②根据电荷守恒、元素守恒,Cl-、AlCl4-、Al2Cl7-体系中的离子方程式是2A1Cl4-
4AlCl3+O2,使O2浓度降低,平衡向右移动,提高转化率,所以实际生产中需加入焦炭;(3)①无水氯化铝熔点190℃,根据图示,大于190℃时,熔融液导电能力差,所以无法电解产生铝单质;②根据电荷守恒、元素守恒,Cl-、AlCl4-、Al2Cl7-体系中的离子方程式是2A1Cl4-![]() Al2Cl7-+ Cl-;③电解时,阳极是AlCl4-放电生成Al2Cl7-和氯气,阳极反应式是4A1Cl4--2e-=2Al2Cl7-+Cl2↑;④根据电解总反应
Al2Cl7-+ Cl-;③电解时,阳极是AlCl4-放电生成Al2Cl7-和氯气,阳极反应式是4A1Cl4--2e-=2Al2Cl7-+Cl2↑;④根据电解总反应![]() ,实质是电解氯化铝,为保证电解进行,n(AlCl3)∶n(NaCl)应大于3:2。
,实质是电解氯化铝,为保证电解进行,n(AlCl3)∶n(NaCl)应大于3:2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
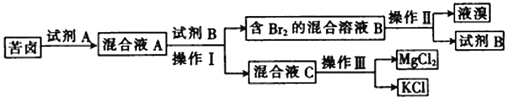
回答下列问题:
(1)若试剂A是一种有色气体单质,则A是_______(填化学式);
(2)“操作II”是_______,“操作III”是_______。(填字母)
a.蒸发 b.蒸馏 c.分液 d.重结晶
(3)试剂B可能是下列物质中的________。(填字母)
a.饱和NaCl溶液 b.CCl4 c.NaOH d.乙醇
Ⅱ.一种工业制备SrCl2·6H2O的生产流程如下图所示:

已知:①M(SrCl2·6H2O)=267g·mol-1;②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;③经盐酸浸取后,溶液中有Sr2+和Cl-及少量Ba2+。
(1)加入硫酸溶液的目的是______________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol·L1 (注:此时滤液中Ba2+浓度为1×105 mol·L1)。
(2)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×102 mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为_______(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的说法正确的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C. 氯水和液氯都能使干燥的有色布条褪色
D. 新制氯水的pH值要比久置氯水的pH值小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室拟用如下装置进行SO2的制备及性质实验
①已知稀硝酸、亚硝酸作为氧化剂时,一般其还原产物为一氧化氮。
②lg2=0.3
③SO2易溶于水,通常条件下溶解的体积比为1∶40

回答下列问题:
(1)①制取SO2反应的化学方程式为_____________________________________________。
②实验开始时加入的5g CaCO3的作用是_____________________________________。
(2)①当__________________时,将NaHSO3晶体抖入烧瓶中,观察到D瓶及E瓶出现大量沉淀,
②写出D瓶中发生反应的离子方程式_____________________________________。
③(1)、(2)两步反应A中的导气管口的位置是_____________。
A.前“a”后“b” B.前“a”后“a” C.前“b”后“b” D.前“b”后“a”
(3)实验结果,B中仍澄清透明,C中稍有浑浊,通过手持技术检测B、C溶液中pH变化得到如下图象:
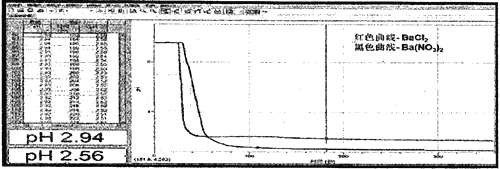
通过理论计算,若C中所有的NO3-被还原,所得溶液冲稀10倍后pH为_______(精确小数点后一位)
(4)结果分析,与实验方案评价SO2通入BaCl2溶液中与通入Ba(NO3)2溶液中pH 相差不大,若估测NO3-能将SO2氧化,理论计算值与实际测得值相差很大,分析其原因是同条件下:稀HNO3的氧化性_____ 稀 HNO2的氧化性(填“强于”或“弱于”或“接近”)。该实验设计在安全方面存在缺陷,请在不增加试剂瓶的前提下加以改进_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下试剂的保存方法,其中不能用氧化还原反应解释的是( )
A. 钠保存在煤油中 B. 氯水保存在棕色的试剂瓶中
C. 保存FeSO4溶液需加入少量铁粉 D. 盛装NaOH溶液的试剂瓶不能用玻璃塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构的相关知识去认识和理解。
(1)H+可与H2O形成H3O+,H3O+ 立体构型为_________。H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为_________________________________________。
(2)COCl2的空间构型为____________;溴的价电子排布式为________________。
(3)根据已经掌握的共价键知识判断,键的极性F-H _______ O-H(“>”,“=”或“<”)
(4)溴化碘和水反应生成了一种三原子分子,该分子的结构式为____________________ ,中心原子杂化轨道类型为________________。
(5)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(6)下列分子既不存在sp σ键,也不存在pp π键的是________。
A.HCl B.HF C.SO2 D.SCl2
(7)ClO2-立体构型为____________,写出与ClO2-互为等电子体的一种分子为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com