
����Ŀ����ͼ��ʾ��һ�ܱ���������Ħ�����ɻ�����������a��b�ֳɼס������ң���״���£��������г���NH3 0.4mol�������г���HCl��N2�Ļ�����壬��ֹʱ����λ����ͼ��ʾ����֪�ס��������������������Ϊ17.3g��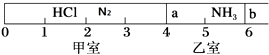
��1�����������������Ϊ ��
��2��������HCl��N2�����ʵ���֮��Ϊ ��
��3��������aȥ������HCl��NH3��ַ�Ӧ����NH4Cl����������˷�Ӧ��������b��λ�ڿ̶ȡ������������֣������ǹ������ʲ�����ѹǿ������ʱ��ϵ��ƽ��Ħ������ ��
���𰸡�
��1��24.1g
��2��1��3
��3��4,25.25g/mol
���������⣺��1�������г���NH3������������Ϊm=nM=0.4mol��17g/mol=6.8g����֪�ס��������������������Ϊ17.3g����������������Ϊ17.3g+6.8g=24.1g��
���Դ��ǣ�24.1g��
��2����ͬ�����£���������ʵ���֮�ȵ��������֮�ȣ���ͼ��֪�ס�����������������Ϊ2��1���������ʵ���֮��Ϊ2��1���������г���NH3 0.4mol�����Լ���������Ϊ0.8mol���������������Ϊ24.1g��
��HCl�����ʵ���Ϊx�����������ʵ���Ϊy��
���������ʵ����������з�����Ϊ�� ![]() �����x=0.2mol��y=0.6mol������HCl��N2�����ʵ���֮��Ϊ0.2mol��0.6mol=1��3��
�����x=0.2mol��y=0.6mol������HCl��N2�����ʵ���֮��Ϊ0.2mol��0.6mol=1��3��
���Դ��ǣ�1��3��
��3��������NH3�����ʵ���Ϊ0.4mol������HCl�����ʵ���Ϊ0.2mol�����Է�Ӧ����NH4Cl���壬ʣ��NH3�����ʵ���Ϊ0.2mol��ʣ������������ʵ���Ϊ0.8mol����ͬ�����£���������֮�ȵ��������ʵ���֮�ȣ���ʼʱ���������ʵ���Ϊ1.2mol�������b��6�����������������ʵ���Ϊ0.8mol�����Ի���b������������4��������ϵ��ƽ��Ħ������M= ![]() =
= ![]() =25.25g/mol��
=25.25g/mol��
���Դ��ǣ�4��25.25g/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�������ͬpH��ijһԪǿ����Һ�ٺ�ijһԪ������Һ�ڷֱ���������п�۷�����Ӧ�����й������������V����ʱ�䣨t���仯��ʾ��ͼ��ȷ���ǣ�������
A.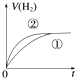
B.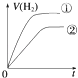
C.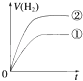
D.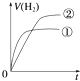
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��ܶȻ��������±���25�棩��
���� | Mg��OH��2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp����λ�ԣ� | 1.1��10��11 | 2.3��10��3 | 1.8��10��10 | 1.9��10��12 |
�����й�˵���в���ȷ���ǣ�������
A.Ũ�Ⱦ�Ϊ0.2 molL��1��AgNO3��Һ��CH3COONa��Һ��������һ������CH3COOAg����
B.��0.001 molL��1��AgN03��Һ����0.001 molL��1��KCl��0.001 molL��1 ��K2CrO4�����Һ�У��Ȳ���Ag2CrO4����
C.0.11 molL��1��MgCl2��Һ�м��백ˮ����Mg��OH��2����ʱ��Һ��pHΪ9
D.�������������������£���AgClˮ��Һ�м���NaCl��Һ��Ksp��AgCl������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�ص������ƶϣ��������ܾ��е������ǣ���������
A. ����������ˮ B. ����������Ӧˮ��������
C. ���ʼ������������л�ԭ�� D. ��̬�⻯����ȶ��Խ�H2S��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ����Һ�д�������ƽ�⣺Cu��OH��2 ��s��Cu2+��aq��+2OH����aq������������Ksp=c��Cu2+��c2��OH����=2��10��20mol2L��2 ��
��ij����ͭ��Һ��c��Cu2+��=0.02mol/L����Ҫ����Cu��OH��2������Ӧ������ҺpHʹ֮���� ��
��Ҫʹ0.2mol/L����ͭ��Һ��Cu2+������Ϊ��ȫ��ʹCu2+Ũ�Ƚ���ԭ����ǧ��֮һ������Ӧ����Һ���������������Һʹ��ҺpHΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaCl��CaCl2��AlCl3������Һ���ֱ���������AgNO3��Һ��Ӧ�������������ʵ����ʵ�����ȣ������ɳ��������ʵ���֮�������������ɳ�����������ȣ���������Һ���������ʵ����ʵ���֮���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N��O��Na��Mg��S��Br�dz���������Ԫ�أ�
��1��Brλ��Ԫ�����ڱ������ڵ��壻Na��O�γ�1��1�Ļ�����ĵ���ʽ�� �� �����ʺ��еĻ�ѧ��Ϊ�� ��
��2���á�����������գ�
�ȶ��� | ���Ӱ뾶 | �۵� | ���ļ��� |
NH3H2O | O2��Mg2+ | SO3 | H��O |
��3����֪������һ�崢�ܵ����һ�ֶ��ε�أ��ṹ��ͼ������ܷ�ӦΪ��2Na2S3+2NaBr ![]() 3Na2S2+Br2�ٷŵ�ʱNa+����Ǩ�ƣ��a��b��������
3Na2S2+Br2�ٷŵ�ʱNa+����Ǩ�ƣ��a��b��������
�ڷŵ�ʱ�����ĵ缫��ӦʽΪ��
��4����֪N4Ϊ��������ṹ��N��N����Ϊ167kJmol��1 �� N��N����Ϊ942kJmol��1 �� д��N4��g��ת��ΪN2��g�����Ȼ�ѧ����ʽ �� 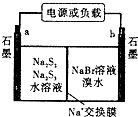
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ200mL2.0mol/L��̼������Һ����ش������й����⣺
��1��ʵ���У�������������ʹ�õ����� ������д��ĸ����
A.250mL����ƿ
B.ϴƿ
C.������ƽ��ҩ�ף�
D.��ƿ
E.������
��2�������������⣬��ȱ�ٵ���������Ʒ���� ��
��3������ƿ�ϣ����п̶Ⱥ���������Ӧ��ע �� ����ƿ��ʹ��ǰ������е�ʵ������� ��
��4�����ƹ���һ����������㡢�������ܽ⡢ת�ơ�ϴ�ӡ����ݡ�ҡ�ȵȲ��裬������ȱ�Ĺؼ������� �� Ӧ��֮��֮ǰ��
��5��ʵ�����ۣ�
�������ƹ����У�������ƿ��ת����Һʱ������Һ�ε�������ƿ���棬��ʵ�����к�Ӱ�죿����д��ƫ��ƫС��Ӱ�죩
�����ڵμ�����ˮʱ�����������̶��ߣ�Ӧ��δ����� ��
��6�����㣺����̼���Ƶ���������Ҫ�й��̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�п��ܺ���Fe2+��Al3+��NH4+��CO32����SO32����SO42����Cl���е������֣���ȡX��Һ��������ʵ�飬ʵ����̼��������£�����˵����ȷ���ǣ� ��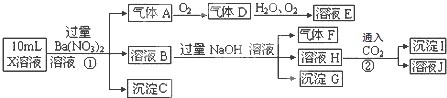
A.X�п϶�����Fe2+��NH4+��SO42��
B.��ҺE������F���ܷ�����ѧ��Ӧ
C.X�п϶�������CO32����SO32����Cl��
D.����I��Al��OH��3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com