
从2L 物质的量浓度为1 mol/L的NaOH溶液中取出100ml,下列关于这100ml溶液的叙述中错误的是( )
A.物质的量浓度为0.1mol/L B.物质的量浓度为1mol/L
C.含NaOH 4g D.含NaOH 0.1mol
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
一定条件下,将X和Y两种气体按不同比例放入固定容积的密闭容器中,反应达平衡后,测得X、Y的转化率与起始时物质的量之比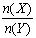 的关系如下图。改变温度和压强,生成物Z的百分含量见下表,则该反应的化学方程式可表示为
的关系如下图。改变温度和压强,生成物Z的百分含量见下表,则该反应的化学方程式可表示为
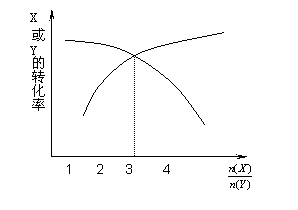
| 温度/℃ | 压强/kPa | Z的质量分数 |
| 200 | 101 | 0.40 |
| 300 | 101 | 0.48 |
| 400 | 202 | 0.52 |
| 400 | 303 | 0.52 |
A.3X(g)+Y(g) 3Z(g) ΔH<0
3Z(g) ΔH<0
B.X(g)+3Y(g) 4Z(g) ΔH>0
4Z(g) ΔH>0
C.3X(g)+Y(g) 4Z(g) ΔH>0
4Z(g) ΔH>0
D.X(g)+3Y(g) 3Z(g) ΔH<0
3Z(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= 。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施
A.增大N2O4起始浓度 B.向混合气中通入NO2
C.使用高效催化剂 D.升高温度
(6)如图是80℃时容器中N2O4浓度的变化图,请在该图中补画出该反应在60℃反应时N2O4浓度的变化曲线。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应8NH3 + 3Cl2===6NH4Cl+ N2 回答以下问题。

 (1)氧化剂 , 还原剂
(1)氧化剂 , 还原剂
 (2)反应中转移的电子数是
(2)反应中转移的电子数是
 (3)氧化剂和还原剂的物质的量之 比
(3)氧化剂和还原剂的物质的量之 比
 (4)当生成28gN2时, 被氧化的物质的质量是 g。.
(4)当生成28gN2时, 被氧化的物质的质量是 g。.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知299K时,合成氨反应3H2(g)+N2(g) 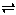 2NH3(g) △H=-92.0kJ/mol,将此温度下的1molN2和3molH2放在一个密闭容器中,在催化剂存在的时候进行反应,测得反应放出的热量为(忽略能量损失)
2NH3(g) △H=-92.0kJ/mol,将此温度下的1molN2和3molH2放在一个密闭容器中,在催化剂存在的时候进行反应,测得反应放出的热量为(忽略能量损失)
A、一定大于92.0kJ B、一定等于92.0k
C、一定小于92.0kJ D、不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示。则下列说法正确的是:
①反应开始到第一次平衡时,N2的平均反应速率为 0.005mol·L-1·min-1
②从曲线变化可以看出,反应进行到10 min至20 min钟时可能是使用了催化剂
③从曲线变化可以看出,反应进行至25min钟时,分离出0.1mol的氨气
④在25min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质属于强电解质且能导电的是
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH
⑥稀硫酸 ⑦乙酸
A.⑤ B.①②⑥ C.②⑤⑥⑦ D.①③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com