
【题目】完成下列计算:
(1)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。若配制该营养液,取428gNH4Cl,则需KCl的质量为________g。
(2)在K2SO4和Al2(SO4)3的混合溶液中,测得Al3+的浓度为0.2molL﹣1,加入等体积0.6molL﹣1的BaCl2溶液恰好使SO42-完全沉淀,则混合溶液中K+的浓度为_____molL﹣1。
(3)某固态化合物X受热分解的反应为:X=A↑+B↑+C↑,在一定的温度和压强下测得反应生成的混合气体对氢气的相对密度为15,则X的摩尔质量是___________。
(4)标准状况下,将V L A气体(摩尔质量为M molL﹣1)溶于0.1L水(密度1g/cm3)中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度为____________molL﹣1。
【答案】74.5 0.6 90 g/mol 1000dw/(VM+2240)
【解析】
(1) 428gNH4Cl的物质的量为![]() =8mol
=8mol
由KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8,
则n(KCl)=1mol,m(KCl)=1mol×74.5g/mol=74.5g;
(2)反应过后溶液为氯化钡和氯化铝的混合溶液,根据电荷守恒得c(K+)+3c(Al3+)=c(Cl-),所以c(K+)=c(Cl-)-3c(Al3+)=0.6molL﹣1-3×(0.2molL﹣1)/2=0.3 molL﹣1,则原混合溶液中c(K+)=0.3 molL﹣1×2=0.6 molL﹣1;
(3) 相同条件下,气体的摩尔质量之比等于其密度之比,反应后生成的混合气体的密度对氢气的相对密度为15,则该混合气体的摩尔质量为30g/mol,假设X为1mol则生成气体的物质的量为3mol,3mol混合气体的质量=30g/mol×3mol=90g,根据质量守恒定律知,X的质量为90g,所以X的摩尔质量=90 g/mol;
(4)c=![]() =
=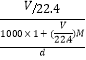 =1000dw/(VM+2240)。
=1000dw/(VM+2240)。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成0.05mol/Lb溶液的pH为1,d能使品红溶液褪色,e是液体,f的焰色反应为黄色,上述物质的转化关系如图所示(个别产物略去)。下列说法错误的是( )

A. 二元化合物沸点:e>d>c B. 氢化物的稳定性:Q>Y>X
C. 元素的非金属性:Y>X>W D. 原子半径的大小:Z>Q>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g) + 2B(g) ![]() 2C(g) ΔH= Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
2C(g) ΔH= Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
A. 平衡前,随着反应进行,容器内气体密度逐渐减小
B. 平衡时,该反应放出的热量为Q kJ
C. 平衡后,再向容器中通入1 mol氦气,A的转化率增大
D. 平衡后,缩小容器容积达到新平衡,A的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。请回答下列问题:
科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的有效途径之一便是实现燃料和燃烧产物之间的良性循环(如图甲所示):
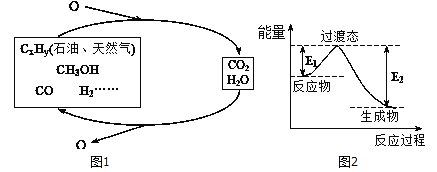
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2,转化为甲醇蒸汽和水蒸气。图乙是生成1molCH3OH时的能量变化示意图。已知破坏1mol不同共价键的能量(kJ) 分别如下表:
C-H | C-O | C=O | H-H | H-O |
413.4 | 351 | 745 | 436 | 462.8 |
①结合上表数据,试写出生成CH3OH的热化学反应方程式:____________________。
②已知E2=189.8kJ·mol-1,则E1=_______。
(2)将不同量的CO(g) 和H2O(g) 分别通入到体积为2L的恒容密闭容器中进行如下反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) 得到如下表所示三组数据:
CO2(g)+H2(g) 得到如下表所示三组数据:
实验 | 温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
1 | 650 | 4 | 2 | 1.6 | 6 | |
2 | 900 | 3 | 2 |
| 3 | |
3 | 900 | |||||
①该反应的△H_______0 (填“<”或“>”)。
②实验2条件下的平衡常数K=_______。
③实验3中,若起始时在容器中加入CO、H2O、CO2、H 2各1mol,则此时v正_______v逆 (填“<”“>”或“=”)。
(3)合成甲醇时所需的CO2 可以利用Na2CO3溶液从工业废气(主要含CO2) 中捕捉,其原理如图:
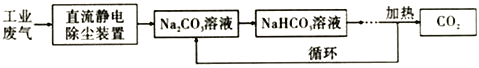
现向100mL 0.1mol/L Na2CO3溶液中通入112mL (已换算为标准状况) CO2,假设溶液中没有晶体析出,试回答下列问题:
①该工业废气处理过程中“静电除尘装置”利用了______________________________的原理。
②用离子方程式解释Na2CO3溶液呈碱性的原因:_____________________。
③反应后所得溶液中的各离子浓度由大到小的顺序是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定条件下,CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
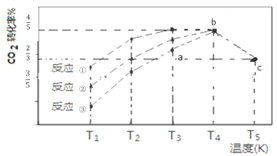
A. a 点 v(正)>v(逆)
B. b点反应放热53.7 kJ
C. 催化剂效果最佳的反应是③
D. c点时该反应的平衡常数K=4/3(mol-2![]() L-2)
L-2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知某KNO3溶液A中,混有少量的Ca2+和SO42-等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体。

根据上述回答:
(1)沉淀D中所含有的物质是___.
(2)按上述实验方案制得的KNO3晶体,经分析测定仍含有杂质,其原因是上述第____步(填①、②、③)可能存在问题,请加以完善:________________________________________ 。
Ⅱ.有A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次减小。
将等物质的量的A、B、C溶于水,所得溶液中只含有Al3+、Na+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是_______。
A.NH4+ B.Ba2+ C.Mg2+ D.Cu2+
(2)写出A的化学式:_________。
(3)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Al3+、Cl-、NO3-、Na+四种离子且物质的量之比依次为1:1:3:1(不考虑水电离的影响)。则A、B、C三种盐的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清洁能源氢气制取与储存是氢能源利用领域的研究热点.
已知:①CH4(g)+ H2O(g)![]() CO(g)+3H2(g) △H =+206.2kJ·mol-1
CO(g)+3H2(g) △H =+206.2kJ·mol-1
②CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g) △H =+247.4kJ·mol-1
2CO(g)+2H2(g) △H =+247.4kJ·mol-1
③2H2S(g)![]() 2H2(g)+S2(g) △H =+169.8kJ·mol-1
2H2(g)+S2(g) △H =+169.8kJ·mol-1
请按要求回答下列问题
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________.
(2)在密闭容器中充入一定量的H2S,发生反应③。如图所示为H2S气体的平衡转化率与温度、压强的关系。
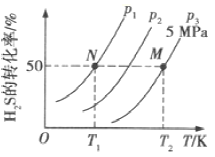
①图中压强(P1、P2、P3)的大小顺序为______,该反应平衡常数的大小关系为K(T1)_____填(“>”“<”或“=”)K(T2)。
②如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有_________。
(3)硫化氢是剧毒气体,尾气中硫化氢有多种处理方法:
①碱溶液吸收。用150 ml 2.0 mol![]() L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
A.c()c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
B.c(Na+)+c(H+)=c(OH-)+ c(HS-)+ c(S2-)
C.2c(Na+)=3[c(H2S)+c(HS-)+ c(S2-)]
D.c(OH-)= c(H+)+ c(HS-)+2 c(H2S)
②纯碱溶液吸收,写出该吸收法发生反应的离子方程式_________________________。已知H2CO3和H2S在25℃时的电离常数如表所示:

③硫酸铜溶液吸收。200mL0.05 mol/ L的CuSO4溶液吸收液中H2S,恰好使反应溶液中Cu2+和S2-浓度相等的溶液中c(Cu2+)为___________________(已知常温下,Ksp(CuS)≈1.0×10-36)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验结论或原理不一致的是
选项 | 实验现象 | 实验结论或原理 |
A | 生活中用泡沫灭火器灭火 | 3HCO3-+Al3+===Al(OH)3↓+3CO2↑ |
B | 向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 | 说明KSP(AgCl)>KSP(AgI) |
C | 向NaHS溶液中滴入酚酞,溶液变红色 | HS-水解程度大于电离程度 |
D | Na2CO3溶液中滴加酚酞呈红色 | CO32-+2H2O |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com