
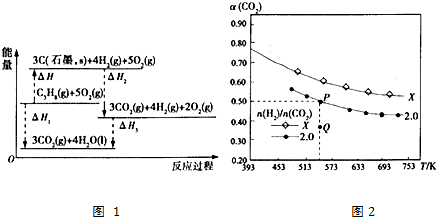
分析 (1)根据能量变化示意图可知,△H=△H1-(△H2+△H3);
(2)①2CO2(g)+6H2(g)?C2H4(g)+4H2O(g),所以平衡常数K=$\frac{{c({C_2}{H_4})•{c^4}({H_2}O)}}{{{c^2}(C{O_2})•{c^6}({H_2})}}$;
由图可知,P点平衡时二氧化碳转化率为0.5,氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$=2,设起始时氢气为2mol/L、二氧化碳为1mol/L,则二氧化碳浓度变化量为0.5mol/L,则:
2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)
起始浓度(mol/L):1 2 0 0
变化浓度(mol/L):0.5 1.5 0.25 1
平衡浓度(mol/L):0.5 0.5 0.25 1
代入平衡常数表达式计算K;
②升高温度,向吸热方向移动,根据转化率的变化来判断该反应是放热还是吸热,从而分析焓变;
③碳氢比越大,二氧化碳转化率越大;
④在氢碳比为2.0时,P点达平衡,Q点未达平衡,此时二氧化碳的转化率比平衡时小,说明此时要继续转化更多的二氧化碳,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大,所以此时逆反应速率比平衡时逆反应速率小.
解答 解:(1)根据能量变化示意图可知,丙烷气体(C3H8)分解得到石墨(C)和氢气的热化学方程式为:C3H8(g)═3C(石墨,s)+4H2(g)△H=△H1-△H2-△H3,
故答案为:C3H8(g)═3C(石墨,s)+4H2(g)△H=△H1-△H2-△H3;
(2)①2CO2(g)+6H2(g)?C2H4(g)+4H2O(g),所以平衡常数K=$\frac{{c({C_2}{H_4})•{c^4}({H_2}O)}}{{{c^2}(C{O_2})•{c^6}({H_2})}}$,
由图可知,P点平衡时二氧化碳转化率为0.5,氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$=2,设起始时氢气为2mol/L、二氧化碳为1mol/L,则二氧化碳浓度变化量为0.5mol/L,则:
2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)
起始浓度(mol/L):1 2 0 0
变化浓度(mol/L):0.5 1.5 0.25 1
平衡浓度(mol/L):0.5 0.5 0.25 1
代入平衡常数表达式K=$\frac{{c({C_2}{H_4})•{c^4}({H_2}O)}}{{{c^2}(C{O_2})•{c^6}({H_2})}}$=$\frac{0.25×{1}^{4}}{0.{5}^{2}×0.{5}^{6}}$=64,
故答案为:$\frac{{c({C_2}{H_4})•{c^4}({H_2}O)}}{{{c^2}(C{O_2})•{c^6}({H_2})}}$;64;
②由图可知,随温度升高CO2的平衡转化率减小,说明升高温度平衡逆向移动,升高温度平衡向吸热反应越大,则正反应为放热反应,故△H<0,
故答案为:<;温度升高CO2的平衡转化率减小,平衡逆向移动,故逆反应是吸热反应,正反应为放热反应;
③由图象可知X的碳氢比不等于2,在相同条件下反应达平衡时,二氧化碳的转化率增大了,说明是增大了氢气的量,提高二化碳的转化率,即碳氢比越大,二氧化碳转化率越大,
故答案为:>;
④在氢碳比为2.0时,P点达平衡,Q点未达平衡,此时二氧化碳的转化率比平衡时小,说明此时要继续转化更多的二氧化碳,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大,所以此时逆反应速率比平衡时逆反应速率小,
故答案为:<.
点评 本题考查热化学反应方程式的书写、化学平衡计算与影响因素、平衡常数、化学平衡图象等,侧重考查对图象的分析获取信息能力,有一定难度.


科目:高中化学 来源: 题型:解答题
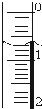 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中NH4+、Al3+、NO3-、Cl-可以共存 | |
| B. | 氧化镁可以用作耐火材料 | |
| C. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| D. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 酸碱指示剂变色、煤的液化、海水提溴、皂化反应都涉及化学变化 | |
| D. | 金属镁着火可使用干粉灭火器灭火,但不可用泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g 30% CH3COOH溶液中含氢原子数为2NA | |
| B. | 标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA | |
| C. | 16gO3和O2混合物中含氢原子数为NA | |
| D. | 精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
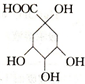
| A. | 1mol X能与5mol NaOH反应 | B. | X能发生加成、取代、氧化反应 | ||
| C. | X的分子式为C7H8O6 | D. | X与乙酸、乙醇均能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响 b.实验1和3探究反应物浓度对该反应速率的影响. c.实验2和4探究催化剂对反应速率的影响 | |
| 体积(mL) | 浓度(mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |

| 试验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com