
【题目】某同学设计下列方案对A盐的水解液进行鉴定:![]() 由此得出的结论中,不正确的是
由此得出的结论中,不正确的是
A. D溶液中存在Fe(SCN)3 B. A一定为无氧酸盐FeBr2 C. B为AgBr D. 滤液中有Fe3+
【答案】B
【解析】
由图中转化可以知道,B为A与硝酸银反应生成的浅黄色沉淀,根据元素守恒知则B为AgBr,所以A中含有Br-,C中加KSCN溶液变为血红色溶液,所以D为Fe(SCN)3溶液,则C中含有Fe3+,A中含有铁元素,硝酸具有强氧化性,能氧化亚铁离子生成铁离子,所以A为可能含有Fe3+或Fe2+。
A、通过以上分析知,D中含有Fe(SCN)3,故A正确;
B、硝酸具有强氧化性,能将亚铁离子氧化生成铁离子,所以A中可能是FeBr2,也可能是FeBr3,也可能是二者的混合物,故B错误;
C、B为A与硝酸银反应生成的浅黄色沉淀,根据元素守恒知则B为AgBr,故C正确;
D、能和硫氰化钾溶液反应生成血红色溶液,说明C中含有Fe3+,故D正确。
综上所述,本题选B。


科目:高中化学 来源: 题型:
【题目】混合物分离和提纯常用下图装置进行,按要求回答下列问题:
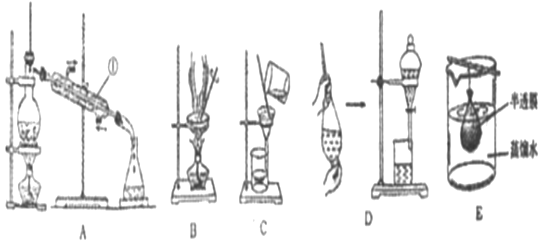
(1)仪器①的名称________________________。
(2)明胶是水溶性蛋白质混合物,溶于水形成胶体。分离明胶的水溶液与Na2CO3、Na2SO4的混合溶液应选用装置的为(用上图字母填写)____________________。如何证明SO42-已分离出来______________________。
(3)在装置D中加入10 mL碘水,然后再注入4 mL苯,盖好玻璃塞,按操作规则反复振荡后静置观察到的现象是:________________________。操作完毕后,为得到碘并回收苯可用______________法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料。难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验。能证明水合草酸亚铁中存在Fe2+的试剂有____(填代号)。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(2) 为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
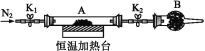
实验步骤如下:
a.打开K1和K2,缓缓通入N2; b.低温加热装置A一段时间;
c.停上加热,冷却到室温; d.关闭K1和K2,称量A;
e. ,记为m3 g。
①补充实验步骤e为__________(填实验操作和要求)。
②步骤b至步骤e继续通入N2的目的是___________________。
(3)为探究草酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
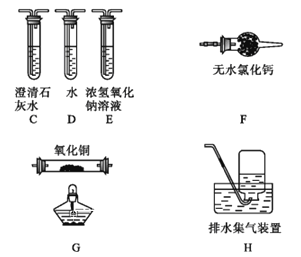
①实验装置中,依次连接的合理顺序为A→_______________。
②证明产物有CO生成的现象是________________。
③写出草酸亚铁受热分解的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用二氧化锰与浓盐酸共热制取氯气。某化学兴趣小组为制取较为纯净、干燥的氯气设计了如下实验装置。

请按要求回答下列问题:
(1)仪器X的名称为_________________。
(2)已知装置B中选用的试剂为饱和食盐水,其作用为 __________________。
(3)将氯气通入C中的紫色石蕊试液,可以观察到的现象是________________________。
(4)装置E中装有NaOH溶液,该装置中反应的化学方程式 ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
某温度下,将2.0 mol CO2(g) 和6.0 mol H2(g)充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质分数变化情况如图所示,则P1_______P2(填“>”“<”或“=”,下同)。若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1________K3,T1、P1时H2的平衡转化率为______________。

②在恒容密闭容器里按体积比为1∶3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是______(填序号)。
A.反应物的浓度增大 B.混合气体的密度减小
C.正反应速率小于逆反应速率 D.氢气的转化率减小
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量、产生的气体与加入盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:当加入HCl 的物质的量为1 mol时,溶液中所含溶质的化学式__________,a点溶液中各离子浓度由大到小的关系式为____________________________________。

(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp = 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4 mol·L-1,则生成沉淀加入CaCl2溶液的最小浓度为___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是

A.N4属于一种新型的化合物
B.N4分子中存在非极性键
C.N4分子中N—N键角为109°28′
D.1 mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:

①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组是( )
A.NH4+、Ag+、CO32﹣、SO42﹣B.Fe3+、H+、NO3﹣、Cl﹣
C.Fe3+、NH4+、I﹣、Cl﹣D.H+、Mg2+、NO3﹣、HCO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com