
| A、氧化钠与过氧化钠都是碱性氧化物 | B、氧化钠与过氧化钠都是白色的固体 | C、NaHCO3比Na2CO3易溶于水 | D、Na2CO3比NaHCO3稳定 |
科目:高中化学 来源:如东县2007年高考化学模拟试题(一) 题型:058
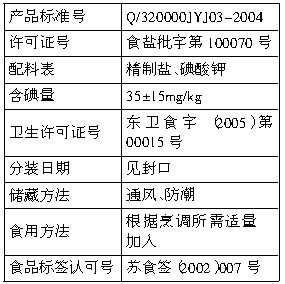
I、下表是如东某超市出售的“淮牌”加碘精制盐的有关说明:

II、下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在.碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源.目前世界上碘主要来自智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在.通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等粘膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡.碘遇淀粉(面粉的主要成分)会出现明显的蓝色.碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2…………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2…………⑵
反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应.
根据以上信息,回答下列问题:
⑴反应⑴、反应⑵的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3=H++HSO3-)反应⑴:________;反应⑵:________;I2在反应⑴中是________(填“氧化”或“还原”,下同)产物,在反应⑵中是________产物;
⑵请你设计实验探究上述“淮牌”精制盐中是否真的含有碘元素.
实验名称:探究“淮牌”精制盐中是否含有碘元素
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应;
2.________.
实验原理:(提示:结合题中信息和实验目的进行分析)________.
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)________.
实验步骤:(用准确、简洁的语言填写下表)

问题讨论:如东有100多km的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是如东人的主要副食品,如东人的食用盐中需要加碘吗?说明你的理由.
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省卫辉市高三1月月考(理综)化学部分 题型:选择题
阅读下面两条科普信息,回答有关问题:
一个体重50kg的健康人身体中含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收:
在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿:该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)。
(1)这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明维生素C具有 性,铁离子具有 性,第二则则信息中CO2是 剂。
(2)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__Fe(NO3)3 +__ NaOH+ __Cl2 → __Na2FeO4+ __NaNO3 + __NaCl + __H2O
①配平上述反应,并分析 元素被氧化,当生成3mol还原产物时,转移电子的总数为 ;
②铁酸钠除了能消毒外,还可以用于净水,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ.下表是诸暨市一百超市出售的“雪涛牌”加碘精制盐的有关说明:
产品标准号 | GB5461-2000 |
配 料 | 精制盐、碘酸钾、抗结剂 |
质量等级 | 一级 |
含碘量 | (35±15)mg/kg |
食用方法 | 待食品熟后加入碘盐 |
储藏方法 | 密判保存、防潮防热 |
分装日期 | 2008年10月8日 |
Ⅱ.下面是某网站上刊出的有关碘及碘的化合物的一些信息:
自然界中碘主要以碘化物和碘酸盐的形式存在。碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源。日前世界上碘主要来自钾利硝石,其中含碘O.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在。通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液。碘遇淀粉(面粉的主要成分)会出现明显的蓝色。碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性。如:
2Nal+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2 (一)
2NaIO3+5NaHSO3=2NaSO4+3NaHSO4+H2O+I2 (二)
反应(一)是从海藻灰中提取碘的主要反应,反应(三)是从智利硝石中提取碘的主要反应。
根据以上信息,回答下列问题:
(1)反应(一)中NaI被 (填“氧化”或“还原”,下同);反应(二)中NaIO3是 剂,若有1.5mol NaIO3发生了反应,则转移的电子是 mol。
(2)下面是某同学设计的,探究上述“雪涛牌”精制盐中是否真的含有碘元素的实验。请你完成空白部分。
实验名称: ① 。
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应
2.认识碘单质的检验方法
实验用品:试管、胶头滴管、“雪涛牌”精制盐、亚硫酸氢钾溶液、淀粉溶液。
实验步骤:
实验步骤 | 实验现象 | 化学方程式或实验结论 |
1.取精制盐少许于一支试管 中,加入适量的水,振荡 | 固体在 水中溶解 | “雪涛牌”精制盐能溶于水 |
2.向上述溶液中滴加适量的亚 硫酸氢钾溶液,振荡 | 溶液变成 棕黄色 | ②(填化学方程式) |
3.再向上述溶液中滴加淀粉溶 液,振荡 | ③ | “雪涛牌”精制盐中含有碘元素 |
问题讨论:我省的温州有很长的海岸线,海产品丰富,海产品中或多或少含有碘元素,而海产品又是温州人的主要副食品,那么温州人的食用盐中需要加碘吗?
并说说你的理由。
④ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com