
| A.NaA溶液的pH>7(室温下) |
| B.pH试纸显示0.1 mol/L HA溶液的pH为2~3(室温下) |
| C.0.1 mol/L的HCl和HA溶液,前者的导电能力明显更强 |
| D.HA溶液能与CH3COONa溶液反应生成CH3COOH |
科目:高中化学 来源:不详 题型:填空题
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- H++SO42- | 10% |
| B | 硫酸氢钠溶液: HSO4- H++SO42 H++SO42 | 29% |
| C | 醋酸: CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.33% |
| D | 盐酸: HCl=H++Cl- | 100% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测定其导电性能相同 |
| B.与足量的锌粉反应的起始速率相同 |
| C.与足量的锌粉反应产生氢气的体积比为1∶1∶100 |
| D.与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1∶2∶100 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
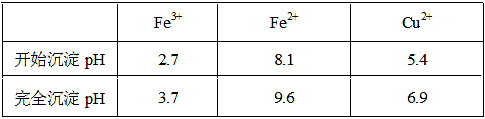
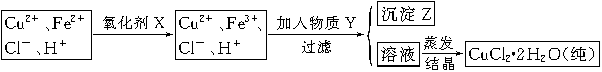
| A.NaClO | B.H2O2 | C.KMnO4 | D.HNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.①②③④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com