
【题目】阿伏加德罗常数值用NA表示。下列说法中正确的是
A. 50 g 46%的乙醇水溶液中含有的氢原子总数为6NA
B. NH4N3(叠氮化铵)发生爆炸:NH4N3![]() 2N2↑+2H2↑当转移4NA个电子时,产生44.8L(标准状况)混合气体
2N2↑+2H2↑当转移4NA个电子时,产生44.8L(标准状况)混合气体
C. 0.1molSO2溶于水,溶液中SO32-、HSO3-、H2SO3的总数为0.1NA
D. 用铂电极电解100 mL 1 mol L-1的CuSO4溶液足够长时间,转移的电子数一定为0.2NA
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( ) 
A.阳极电极方程式为Al﹣3e+6OH﹣=Al2O3+3H2O
B.随着电解的进行,溶液的pH逐渐增大
C.当阴极生成气体3.36L(标况)时,阳极增重2.4g
D.电解过程中H+移向Al电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( ) 
A.a 点所示溶液中 c(Na+)>c(A﹣)>c(H+)>c(HA)
B.a、b 两点所示溶液中水的电离程度相问
C.b点所示溶液中c(A﹣)>c(HA)
D.pH=7时,c(Na+)﹣=c(A﹣)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下正戊烷(CH3CH2CH2CH2CH3)易发生两种裂解反应:
I.CH3CH2CH2CH2CH3(g)![]() CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
II.CH3CH2CH2CH2CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
(1)维持体系温度T不变,总压强p恒定时,体积为V1L的正戊烷发生裂解反应,一段时间平衡后气体体积变为V2L,此时正戊烷的转化率α(正戊烷)=_______;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将______(填“增大”“减小”或“不变”),原因为_____________。
(2)一定温度下,向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5molCH3CH3发生反应CH3CH=CH2(g)+CH3CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
①△H3=________。
②5min内,该反应的平均反应速率v(CH3CH3)=________。
③保持温度不变,起始时向该密闭容器中充入等物质的量的CH3CH=CH2和CH3CH3,平衡后容器内CH3CH3的体积分数为______(保留一位小数)。
(3)将0.1molCH3CH3完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
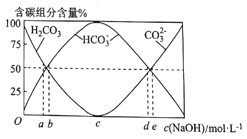
其中图中表示原氢氧化钠浓度为3mol.L-1的是_____(填“a”“b”“c”“d”或“e”)。
(4)以氢氧化钠溶液为电解质溶液,CH3CH3燃料电池的负极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由阿伏伽德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水),不能确定的物理量有( )
A.1摩尔水的质量
B.1摩尔水蒸气的质量
C.1摩尔水的体积
D.1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年新学期初,市教育局在全市中小学开展了“节约用水用电,倡导绿色简约生活”的活动。下列做法不应该提倡的是
A.路远的同学可乘公交车上学B.作业不要使用修正带或涂改液
C.将化学实验室的废水直接排入水池D.养成随手关水关灯的习惯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为( )
①a-4 ②a-5 ③a+3 ④a+4
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料及催化剂等方面应用广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺流程:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___________________,“浸渣”的成分除Fe2O3,FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnC12将Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnC12后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,滴定时反应的离子方程式为____________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol,当除钙率达到99%时,除钙后的溶液中c(F-)=____mol·L-1[已知Ksp(CaF2)=4.0×10-11]。
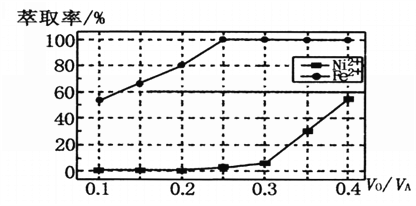
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.将Na2CO3固体加入新制的氯水中,有无色气泡(H+)
B.向淀粉KI溶液中滴加新制氯水,溶液变蓝(Cl2)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl﹣)
D.新制氯水使红色布条褪色(HCl)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com