
| A. | 新制氯水中只含氯气和水分子 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,该气体是氯气 | |
| D. | 氯水放置数天后pH将变大 |
分析 A.新制氯水中存在化学平衡,存在氯气、次氯酸、水分子;
B.氯水中含有盐酸使蓝色石蕊试纸先变红,次氯酸具有漂白性使色石蕊试纸褪色;
C.氯水中次氯酸见光分解生成氧气;
D.氯水中次氯酸见光分解生成盐酸和氧气,溶液PH变小;
解答 解:A.新制氯水中存在化学平衡,Cl2+H2O?HCl+HClO,存在氯气、次氯酸、水分子,故A错误;
B.新制氯水中存在化学平衡,Cl2+H2O?HCl+HClO,氯水中含有盐酸使蓝色石蕊试纸先变红,次氯酸具有漂白性使色石蕊试纸褪色,新制氯水可使蓝色石蕊试纸先变红后褪色,故B正确;
C.氯水中次氯酸见光分解生成氧气,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,故C错误;
D.氯水中次氯酸见光分解生成盐酸和氧气,氢离子浓度增大溶液PH变小,故D错误;
故选B.
点评 本题考查了氯气的性质,主要是氯水中的化学平衡、产物判断和产物性质分析,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | R一定是第2周期元素 | |
| B. | R一定是VA族元素 | |
| C. | R的气态氢化物一定比同周期其他元素气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
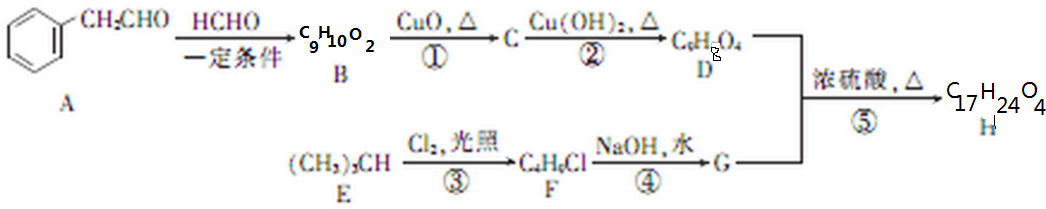
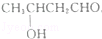
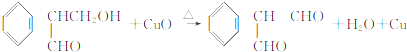
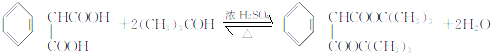
 (不考虑立体异构)?
(不考虑立体异构)?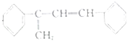 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com