
| A. | FeCl3溶液 | B. | 石蕊试液 | C. | 浓溴水 | D. | FeCl2溶液 |
分析 加入氯化铁时,苯酚呈紫色,乙醇无明显现象,NaOH与氯化铁反应生成红褐色沉淀,硝酸银溶液生成白色沉淀,硫氰化钾溶液呈红色,现象各不相同,以此来解答.
解答 解:A.苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液分别与氯化铁反应的现象为紫色、无色、红褐色沉淀、白色沉淀、血红色溶液,现象不同,可鉴别,故A选;
B.石蕊不能鉴别苯酚、乙醇等,故B不选;
C.溴水不鉴别乙醇、硫氰化钾,故C不选;
D.FeCl2溶液不能鉴别苯酚、乙醇以及硫氰化钾,故D不选.
故选A.
点评 本题考查物质的鉴别,题目难度较大,把握物质的性质与反应现象为解答本题的关键,涉及的反应较多,注意氧化还原反应及络合反应反应为解答的难点,要注意总结和积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
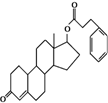
| A. | 含有四种官能团 | B. | 分子中所有碳原子不可能共平面 | ||
| C. | 是一种芳香族化合物 | D. | 含有一个酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | X溶液的体积(mL) | X溶液的浓度(mol/L) | 水的体积(mL) | |
| A | 10℃ | 20 | 3 | 10 |
| B | 20℃ | 30 | 2 | 0 |
| C | 20℃ | 10 | 4 | 20 |
| D | 10℃ | 10 | 2 | 20 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①④ | C. | ①④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个周期,8个主族 | |
| B. | 最外层电子数相同的元素一定在同一族 | |
| C. | 短周期元素中可能有副族元素 | |
| D. | 元素周期表有18个纵行,共16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
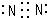 .A的最高价氧化物对应的水化物的电子式
.A的最高价氧化物对应的水化物的电子式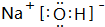 .
.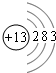 ,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com