
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| 1 |
| 3 |


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
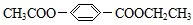 如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题:
如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题: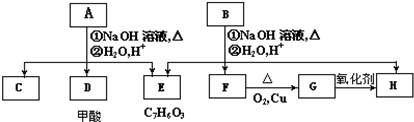
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲、乙、丙、丁 |
| B、乙、甲、丙、丁 |
| C、乙、甲、丁、丙 |
| D、丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 试剂 | 判断方法 |
| A | 稀硝酸 | 是否生成蓝色溶液 |
| B | 稀硫酸 | 固体物质是否完全溶解 |
| C | 浓硫酸 | 是否有无色气体生成 |
| D | 稀盐酸 | 是否生成蓝色溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
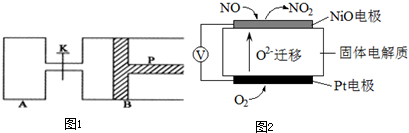
查看答案和解析>>
科目:高中化学 来源: 题型:
A、将容器体积变为10L,Z的平衡浓度变为原来的
| ||
| B、以X浓度变化表示的反应速率为0.001mol/(L?S) | ||
| C、若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、若增大压强,则物质Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
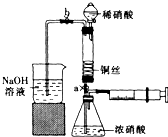 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com