
| A. | 硝酸钾、氢氧化钠 | B. | 氧化铜、二氧化锰 | C. | 氯化钾、二氧化锰 | D. | 硫酸铜、氢氧化钡 |
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:实验题
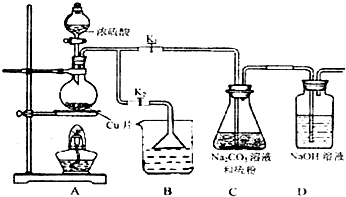
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | △H=E2-E1 | |
| B. | 反应物断键吸收的总能量小于生成物成键释放的总能量 | |
| C. | 升高温度,不影响活化分子百分数 | |
| D. | 使用催化剂使该反应的反应热发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
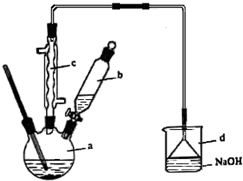 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 .该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;
.该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
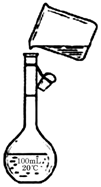 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解搅拌时有液体飞溅 | |
| B. | 取KMnO4样品时不慎在表面沾了点蒸馏水 | |
| C. | 定容时俯视容量瓶刻度线 | |
| D. | 定容摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定存在SO42-、NH4+、Cl- | |
| B. | 原溶液中一定不存在Br-、Fe2+、SO32- | |
| C. | 原溶液中可能存在SO32-、K+ | |
| D. | 原溶液中滴定存在K+,c(K+)≥0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 收集Cl2用排饱和食盐水的方法 | |
| B. | 加催化剂,使SO2和O2 在一定条件下转化为SO3 | |
| C. | 可用浓氨水和NaOH(s)快速制取氨气 | |
| D. | 加压条件下有利于N2和H2反应生成NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com