
| A. | 除了③ | B. | ①②④ | C. | ③⑤ | D. | 除了⑤ |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
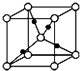 生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中:Cl-、HCO3-、K+、Ba2+ | |
| B. | FeCl3溶液中:K+、NH4+、Br-、SCN- | |
| C. | $\frac{c{(H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | KMnO4的溶液中:H+、SO42-、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/L | B. | 1.5mol/L | C. | 1.6mol/L | D. | 2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类化合物都具有相同的官能团 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的酯类 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 单质是密度最小的气体 |
| M | 其单质为生命活动不可缺少的气体 |
| X | 短周期中原子半径最大的元素 |
| Y | 地壳中含量最高的金属元素 |
| Z | 最外层电子数是最内层电子数的3倍 |
| E | 单质为黄绿色气体 |
| 沸点 | 气态氢化物稳定性 | 最高价氧化物 对应水化物的碱性 | 得电子能力 |
| A2M>A2Z | Z< E | X> Y | 16M= 18M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com