
| A、2Na+2H2O=2NaOH+H2↑是酸碱反应 |
| B、C1O-+H2O?HClO+OH-是酸碱反应 |
| C、碱性强弱顺序:ClO->OH->CH3COO- |
| D、HCO3-既是酸又是碱,NH3既不是酸又不是碱 |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
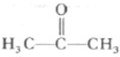
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙烷中的少量乙烯:通入氢气,使乙烯全部转化为乙烷 |
| B、提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离 |
| C、除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 |
| D、检验卤代烃中的卤素原子:取少量卤代烃,加入NaOH水溶液,充分加热一段时间后,在水解液中加入AgNO3溶液,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸和氢氧化钾溶液的反应 |
| B、硝酸和氢氧化铜溶液的反应 |
| C、盐酸和澄清石灰水的反应 |
| D、硫酸和氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、消耗2mol SO2的同时生成2mol SO3 |
| B、SO2、O2与SO3的百分含量不再改变 |
| C、反应混合物中,SO3的质量分数不再改变 |
| D、反应混合物中各物质的物质的量不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L NH3和HF的混合物,所含电子总数为2NA |
| B、7gCnH2n中含氢原子数为nNA |
| C、0.1mol O22-所含的电子数为1.8NA |
| D、40g金刚砂中所含的共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a的能量一定高于c |
| B、b的能量一定高于d |
| C、a和b的总能量一定低于c和d的总能量 |
| D、因为该反应为吸热反应,所以必须加热才可以发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com