
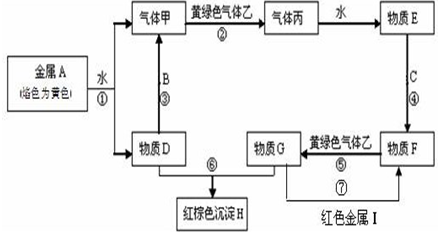
 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、干电池的负极是锌筒 |
| B、MnO2在碳棒上发生还原反应 |
| C、闲置时间过长干电池也会失去供电能力 |
| D、工作时电解液中的NH4+移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的两个实验装置,溶液的体积均为200mL.开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液和体积变化,下列叙述中正确的是( )
如图所示的两个实验装置,溶液的体积均为200mL.开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液和体积变化,下列叙述中正确的是( )| A、产生气体的体积:①>② |
| B、溶液的pH变化:①减小,②增大 |
| C、电极上生成物质的质量:①=② |
| D、电极反应式:①中阳极2Cl--2e-═Cl2↑,②中负极2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 、-CHO
、-CHO查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、加入Na2SO4可使溶液由a点变到b点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b点有BaSO4沉淀生成 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com