
| A. | 升高温度能加快化学反应速率 | B. | 减小压强能减慢化学反应速率 | ||
| C. | 反应生成SO3的物质的量小于2 mol | D. | 达平衡时反应即停止 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 与
与 F.
F.  与
与
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能发生银镜反应的有机物一定属于醛类 | |
| B. | 乙烯和聚乙烯互为同系物 | |
| C. | 室温下,乙醇在水中的溶解度大于溴乙烷 | |
| D. | 乙醇与乙醚互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | 向稀氨水中通入少量CO2:2NH3•H2O+CO2═2NH4++CO32-+H2O | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 将醋酸滴入硅酸钠溶液中:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氯甲烷的电子式为: | B. | 乙醇分子的球棍模型为: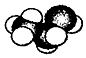 | ||
| C. | 甲苯分子中所有的原子可以共平面 | D. | 分子组成为C5H12的有机物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com