
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol碳正离子(CH3+)所含的电子总数为9NA
B.25℃,pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA
C.常温常压下,过氧化钠与水反应时,生成8g氧气转移的电子数为0.5NA
D.1mol雄黄(As4S4),结构如图:![]() ,含有2NA个S-S键
,含有2NA个S-S键
科目:高中化学 来源: 题型:
【题目】室温下,下列说法正确的是![]()
A.将![]() 的盐酸和
的盐酸和![]() 的硫酸等体积混合,所得溶液
的硫酸等体积混合,所得溶液![]()
B.HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大
C.向![]()
![]() 氨水中加入少量硫酸铵固体,溶液中
氨水中加入少量硫酸铵固体,溶液中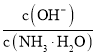 增大
增大
D.将1mL![]() 的HA溶液稀释到10mL,若溶液的
的HA溶液稀释到10mL,若溶液的![]() ,则HA为弱酸
,则HA为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列对该化合物的说法中,正确的是( )

A. 名称是乙醚
B. 只含有一种官能团
C. 链状同分异构体中,属于羧酸的有3种
D. 既能发生加聚反应,又能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于工业合成氨反应:N2+3H2![]() 2NH3,下列说法错误的是( )
2NH3,下列说法错误的是( )
A.使用合适的催化剂可以加大反应速率B.升高温度可以增大反应速率
C.增大N2浓度可以使H2完全反应D.增大N2浓度可以增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,极易溶于水,不与水反应。若温度过高,二氧化氯的水溶液可能会发生爆炸。某研究性学习小组拟用如下图所示装置制取并收集ClO2(加热和夹持装置均省略)。

(1)在圆底烧瓶中先放入一定量的KClO3和草酸H2C2O4),然后再加入足量的稀硫酸,在60~80℃之间反应生成ClO2、CO2和一种硫酸盐,该反应的化学方程式为________。
(2)装置A中使用温度计的目的是____。反应开始后,可以观察到圆底烧瓶内的现象是_____。
(3)装置B的作用是________。
(4)实验过程中装置D中的溶液里除生成Na2CO3外,还生成物质的量之比为1︰1的另外两种盐,一种为NaClO3,另一种为_______。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液20mL,稀释成100mL试样,量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用 cmol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液V2mL。
已知:2ClO2+8H++10I-==5I2+2C1-+4H2O 2Na2S2O3+I2=Na2S4O6+2NaI
请回答:
①配制100mL步骤3中所需的Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要_______。(填仪器名称)
②步骤3中滴定终点的现象为_______。
③原ClO2溶液的浓度为_______g·L-1(用含字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下X、Y、Z、W、R五种元素均为短周期元素,它们的化合价与原子序数的关系如图,下列说法正确

A.简单离子的半径: Y>Z>X
B.最高价氧化物对应水化物的酸性: R>W
C.单质的还原性: Z>Y
D.简单氢化物的沸点: W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.碘化亚铁中通入过量氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
C.1molL﹣1的NaAlO2溶液和2.5molL﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+=Al3++Al(OH)3↓+H2O
D.用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com