
| A、Cl2+2FeCl2→2FeCl3 |
| B、Br2+2Fe2+→2Fe3++2Br- |
| C、2FeCl3+2KI→2FeCl2+2KCl+I2 |
| D、I2+2Fe2+→2I-+2Fe3+ |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| A、Cl2 |
| B、NaClO |
| C、KMnO4 |
| D、Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢化物沸点:HI>HBr>HCl>HF |
| B、分子稳定性:HF>HCl>HBr>HI |
| C、离子半径:K+>Cl->S2- |
| D、单质熔点:Li<Na<K<Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a是阴极 |
| B、电解过程中溶液的浓度不变 |
| C、电解过程中b极质量减少 |
| D、阳极与阴极上的产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
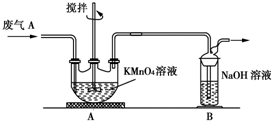 硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气A的组成进行探究,请回答下列问题.
硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气A的组成进行探究,请回答下列问题.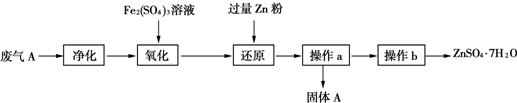
查看答案和解析>>
科目:高中化学 来源: 题型:
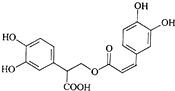
| A、迷迭香酸的所含官能团为:羟基、羧基、酯基和苯环 |
| B、1mol迷迭香酸最多能和8mol H2发生加成反应 |
| C、迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D、1mol迷迭香酸最多能和含5mol Br2单质完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com