
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1 )称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: |
(2 )将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2 )A的分子式为: . |
(3 )另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3 )该有机物分子中含有羟基、羧 |
(4 )A的核磁共振氢谱如图: | (4 )A中含有种氢原子. |
(5 )综上所述,A的结构简式 , | |
【答案】90;C3H6O3 ;![]() ;4;
;4;![]()
【解析】解:(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的分子式量为:45×2=90, 所以答案是:90;(2)浓硫酸增重5.4g,则生成水的质量是5.4g,生成水的物质的量是: ![]() =0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是:
=0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是: ![]() =0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3 ,
=0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3 ,
所以答案是:C3H6O3;(3)只有羧基可以和碳酸氢钠发生化学反应生成二氧化碳,生成2.24LCO2(标准状况),则含有一个羧基,醇羟基可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),则含有羟基数目是1个;羟基为中性原子团,其电子式为 ![]() ,
,
所以答案是: ![]() ;(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效H原子,
;(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效H原子,
所以答案是:4;(5)有机物A的分子式为C3H6O3 , 含有官能团为:﹣COOH、﹣OH,分子中含有4种类型的等效氢原子,氢原子的个数比是3:1:1:1,所以A的结构简式为: ![]() ,
,
所以答案是: ![]() .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(14分)近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能.回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是(填标号).
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10molL﹣1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、 , 制得等量H2所需能量较少的是 .
(3)H2S与CO2在高温下发反应:生H2S(g)+CO2(g)COS(g)+H2O(g).在610k时,将0.10mol CO2与0.40mol H2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.
①H2S的平衡转化率a1=%,反应平衡常数K= .
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率a2a1 , 该反应的△H0.(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是(填标号)
A.H2S B.CO2 C.COS D.N2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热为可燃物的燃烧热的是[ ]
A.H2(g)+1/2O2(g)=H2O(g) △H =-241.8kJ·mol—1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-846.3kJ·mol—1
C.C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol—1
D.C3H8(g)+5O2(g)=3CO(g)+4H2O(l)△ H = -2044.0kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法不正确的是
A. 化学键是一种作用力
B. 化学键可以使离子相结合,也可以使原子相结合
C. 化学反应过程中,反应物分子内的化学键断裂,产物中的化学键形成
D. 极性键、非极性键和氢键等都属于共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施中能减慢食品的腐败,延长其保质期的是 ( )
①降温冷冻 ②用盐腌制 ③加热烘干 ④适当地使用防腐剂
A.①②
B.④
C.①②④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是金属元素跟非金属元素形成的化合物都是离子化合物
B. 氢键是化学键的一种
C. 第ⅠA族和第ⅦA族原子化合时,一定生成离子键
D. 离子化合物中可能存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别欲用图所示实验装置制取并收集氨气. 
(1)其中有一位同学没有收集到氨气,你认为没有收集到氨气的同学是(填“甲”或“乙”或“丙”),原因是 .
(2)要制取纯净的氨气,应该选用(填“甲”或“乙”或“丙”)同学的装置.为确定试管内是否已收集满氨气,可将蘸浓盐酸的玻璃棒置于收集气体的试管口处,若观察到 , 则说明氨气已收集满.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.S2和S8的混合物共6.4 g,所含硫原子数一定为0.2NA
B.将100 mL 0.1 molL﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA
C.在反应KClO3+6HCl═KCl+3Cl2↑+3H2O中,每生成3 mol Cl2 , 转移的电子数为6NA
D.将含有1 mol Na2CO3的溶液逐滴加入到含1.5 mol HCl的溶液中,产生气体的分子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验.请回答下列问题: 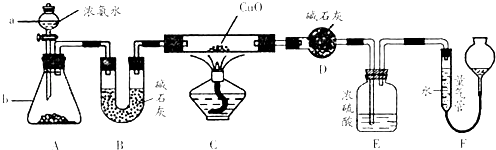
(1)仪器a的名称为;仪器b中可选择的试剂为 .
(2)实验室中,利用装置A,还可制取的无色气体是 (填字母).
A.Cl2
B.O2
C.CO2
D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有性,写出相应的化学方程式
(4)E装置中浓硫酸的作用 .
(5)读取气体体积前,应对装置F进行的操作:
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含m、n字母的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com