(2012?河西区一模)某同学设计了如下实验Ⅰ和实验Ⅱ,测定某氯化铁与氯化亚铁的混合物
中铁元素的质量分数x.请按要求回答下列问题:
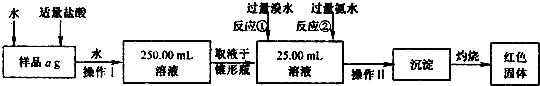
实验Ⅰ:
(1)样品中加入盐酸的作用是.
(2)操作Ⅰ溶液配制过程中所用到的玻璃仪器除烧杯、玻璃棒外,还需要的有(填
仪器名称)
250 mL容量瓶、胶头滴管
250 mL容量瓶、胶头滴管
;操作n名称为
过滤洗涤
过滤洗涤
.
(3)反应①的离子反应方程式为
2Fe2++Br2=2Fe3++2Br-
2Fe2++Br2=2Fe3++2Br-
.
(4)若坩埚质量是W
1g,坩埚与最终灼烧后的固体总质量是W
2 g,则样品中铁元素
的质量分数(化简代数式)x
1=
实验Ⅱ:
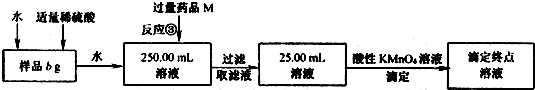
(5)反应③的离子方程式为
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.
(6)若3次平行滴定实验,平均消耗c mol/L KMnO4溶液的体积为d mL,则样品中铁元素的质量分数(化简代数式)x
2=
若样品溶解仍使用盐酸而不改用稀硫酸,则所得样品中铁元素的质量分数将(填“偏大”、“偏小”或“无影响”)
偏大
偏大
.
(7)你认为实验II的设计不足之处有
实验Ⅱ操作过程中Fe2+易被空气中氧气氧化,会导致x偏小;CuCl2溶液的颜色会干扰滴定终点的判断.
实验Ⅱ操作过程中Fe2+易被空气中氧气氧化,会导致x偏小;CuCl2溶液的颜色会干扰滴定终点的判断.
.




