
 某混合物A,含有Al2(SO4)3、Al2O3、Fe2O3,在一定的条件下可实现如图所示的变化.请回答下列问题:
某混合物A,含有Al2(SO4)3、Al2O3、Fe2O3,在一定的条件下可实现如图所示的变化.请回答下列问题:分析 A溶于水得沉淀F和溶液G,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G为硫酸铝溶液,沉淀F为氧化铝和氧化铁;将沉淀F溶于过量氢氧化钠溶液中,氧化铝能与氢氧化钠反应,氧化铁与氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2溶液,溶液G中加入过量的氨水得到沉淀E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,据此进行解答.
解答 解:根据流程可知:A溶于水得沉淀和溶液,溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁;将沉淀F溶于过量NaOH溶液中,Al2O3能和氢氧化钠反应,Fe2O3和氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2;溶液G中加入过量的氨水得到沉淀E,则E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是Al2O3,硫酸铝和氨水反应生成Al(OH)3和硫酸铵,
(1)分离溶液和固体的操作方法为过滤,进行过滤操作用到的玻璃仪器有:漏斗、玻璃棒、烧杯,故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)通过以上分析知,B是Al2O3,C是Fe2O3,D是NaAlO2,E是Al(OH)3,故答案为:Al2O3;Fe2O3;NaAlO2;Al(OH)3;沉淀F与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+2H2O,故答案为:Al2O3+2OH-=2AlO2-+2H2O;
(3)溶液G中含有铝离子,铝离子与过量稀氨水反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)沉淀E是氢氧化铝,和稀硫酸反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O.
点评 本题考查了常见物质的分离与提纯方法综合应用,题目难度中等,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质,试题有利于培养学生的分析、理解能力及逻辑推理能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 ,C离子的电子排布式为1s22s22p63s23p6
,C离子的电子排布式为1s22s22p63s23p6查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水--棕色瓶、阴凉处 | B. | 氢氟酸--橡皮塞、玻璃瓶 | ||
| C. | 少量金属钠--广口瓶、煤油里 | D. | 稀盐酸--细口瓶、阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
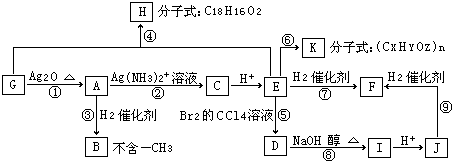
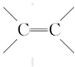 .
.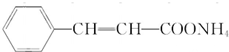 .物质K的结构简式
.物质K的结构简式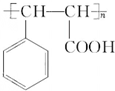 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴乙烷与NaOH水溶液混合加热 | |
| B. | 甲醇与浓硫酸混合加热 | |
| C. | 乙醇与浓硫酸混合加热 | |
| D. | 2-溴丁烷与NaOH的乙醇溶液混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算KCl所需的质量 | 需要的KCl质量为7.5g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器是托盘天平、药匙 |
| (3)将KCl加入100mL的烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是搅拌、加热、研细氯化钾等措施 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠放入水中:Na+2H+=2Na++H2↑ | |
| B. | 铜粉放入硝酸银溶液里:Cu+2Ag+=Cu2++2Ag | |
| C. | 氢氧化钡跟硫酸铜溶液的反应:Ba2++2OH-+Cu2++SO2-4=BaSO4↓+Cu(OH)2↓ | |
| D. | 氯化铁溶液中滴加硝酸银溶液:Cl-+Ag+=AgCl↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com