

| A. | 滴定过程中总是存在:Ka>Kh | |
| B. | 点②所示溶液中存在:c(Na+)=c(A-) | |
| C. | 点③所示溶液中存在:c(Na+)=c(A-)+c(HA) | |
| D. | 向点①所示溶液中加水:$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$比值减小 |
分析 A.①点,溶液中溶质为等物质的量浓度的HA和NaA,溶液呈酸性,说明HA的电离程度大于A-水解程度;
B.点②溶液pH=7,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断c(Na+)、c(A-)相对大小;
C.点③酸碱恰好反应生成NaA,溶液中存在物料守恒,根据物料守恒判断;
D.$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$=$\frac{c({A}^{-}).c({H}^{+})}{c(O{H}^{-}).c({H}^{+}).c(HA)}$=$\frac{{K}_{a}}{{K}_{w}}$,平衡常数只与温度有关.
解答 解:A.①点,溶液中溶质为等物质的量浓度的HA和NaA,溶液呈酸性,说明HA的电离程度大于A-水解程度,其电离程度或水解程度越大,电离平衡常数或水解平衡常数越大,所以滴定过程中总是存在:Ka>Kh,故A正确;
B.点②溶液pH=7,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(A-),故B正确;
C.点③酸碱恰好反应生成NaA,溶液中存在物料守恒,根据物料守恒得c(Na+)=c(A-)+c(HA),故C正确;
D.平衡常数只与温度有关,温度不变,电离平衡常数、离子积常数不变,所以$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$=$\frac{c({A}^{-}).c({H}^{+})}{c(O{H}^{-}).c({H}^{+}).c(HA)}$=$\frac{{K}_{a}}{{K}_{w}}$不变,故D错误;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确混合溶液中溶质及其性质是解本题关键,注意:所有的平衡常数只与温度有关,与溶液浓度及酸碱性无关,易错选项是D.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:解答题
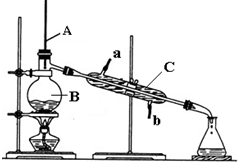 工业酒精是含水约4%的液态乙醇,已知CaO和Ca(OH)2均不溶于乙醇.实验室可用如图所示的装置除去工业酒精中的水,请回答下列各问题.
工业酒精是含水约4%的液态乙醇,已知CaO和Ca(OH)2均不溶于乙醇.实验室可用如图所示的装置除去工业酒精中的水,请回答下列各问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④ | C. | ①③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
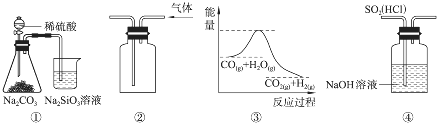
| A. | 图④装置可以用来除去SO2中的HCl | |
| B. | 用图②所示实验装置排空气法收集CO2气体 | |
| C. | 图③表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H大于0 | |
| D. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等浓度的KHSO4溶液与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 在次氯酸中加入碳酸钠:2HClO+CO32-═2ClO-+H2O+CO2↑ | |
| C. | 钾与水反应:2K+2H2O═2K++2OH-+H2↑ | |
| D. | 氯化钠溶液中通入氟气:F2+2Cl-═2F-+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向4mL0.01mol/LKMnO4酸性溶液中加入2mL0.1mol/LH2C2O4溶液:溶液褪色 | |
| B. | 浓度均为0.1mol/L的Na2S2O3和H2SO4溶液等体积混合:溶液变浑浊 | |
| C. | 将盛有NO2和N2O4混合气体的容器压缩:混合气体颜色比压缩前浅 |
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系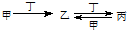 ,下列有关物质的推断不正确的是
,下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2 B.若甲为Fe,则丁可能是盐酸
C.若甲为SO2,则丁可能是氨水 D.若甲为NaOH 溶液,则丁可能是H2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com