
【题目】R、Q为短周期中的两种元素,R元素原子的最外层电子数与次外层电子数之差的绝对值等于电子层数;Q元素原子的最外层电子数是次外层电子数的3倍,则下列叙述中肯定不正确的是( )。
A.原子半径:R>Q
B.R和Q可形成离子化合物R2Q5
C.R和Q可形成共价化合物RQ
D.R和Q可形成共价化合物RO2
科目:高中化学 来源: 题型:
【题目】在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4 s时测得各物质的浓度如表,则下列判断正确的是( )
测定时刻/s 浓度 | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t3 s时反应已经停止
B. t3~t4 s内正、逆反应速率不相等
C. 在容器中发生的反应为A(g)+B(g) C(g)
D. 在t2~t3 s内A的平均反应速率为![]() mol/(L·s)
mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的是

A. 利用图1装置进行喷泉实验 B. 利用图2装置吸收HCl气体,并防止倒吸
C. 利用图3装置制备C12 D. 利用图4装置收集SO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是
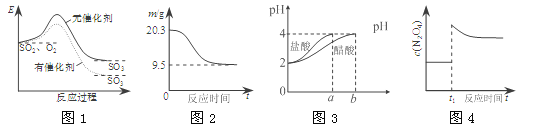
A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
C.图3表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100
D.图4表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A. | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
B. | 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C. | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀。 | 酸性:H2CO3 >H2SiO3 |
D. | 室温下,用pH试纸测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 | HSO3-结合H+的能力比 SO32-的强 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2L的密闭容器中充入一定量的H2O和CO,维持700℃发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
反应时间/min | n(CO)/mol | H2O/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 其他条件不变,起始时容器中充入0.60molCO和1.20 molH2O,达平衡时,n(CO2)=0.40 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D. 若温度升至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.0 kJ mol-1
CH3OH(g) △H1=-90.0 kJ mol-1
②2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
回答下列问题:
(1)若由合成气(CO、H2)制备lmolCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=________kJ mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)有人模拟该制备原理,500K时,在2L的密闭容器中充入2molCO和6mol H2,5min达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2mol·L-1,用H2表示反应①的速率是_______mol·L-1·min-1,可逆反应②的平衡常数K2=_________。
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),此时反应②的v正_______v逆(填“>”、“< ”或“=”)。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,下列说法正确的是_______。
A.在平衡移动过程中逆反应速率先增大后减小
B.容器中CH3OCH3的体积分数增大
C.容器中混合气体的平均相对分子质量减小
D.达到新平衡后体系的压强增大
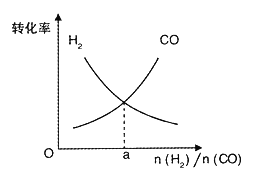
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a =_________(填数值)。
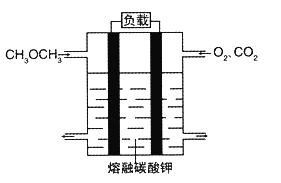
(5)绿色电源“二甲醚燃料电池”的结构图所示,电解质为熔融态的碳酸盐(如熔融 K2CO3),其中CO2会参与电极反应。工作时负极的电极反应为____________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com