
| (0.0025-0.0015)mol |
| 0.025L+0.015L |


科目:高中化学 来源: 题型:
| A、为了更好地控制蒸汽温度,应将温度计向下插入接近液面处 |
| B、为了防止暴沸,在对液体混合物进行蒸馏操作时应该加入沸石 |
| C、为了保证冷凝效果,冷凝水应从冷凝管的下口流入上口流出 |
| D、牛角管的作用是使冷凝后的液体沿着其方向流入锥形瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
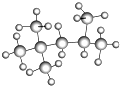
科目:高中化学 来源: 题型:
查看答案和解析>>
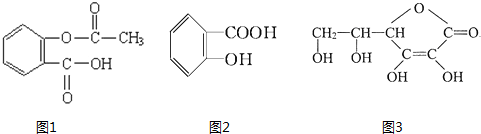
科目:高中化学 来源: 题型:
 的名称(系统命名法)是
的名称(系统命名法)是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中键能越大,键长越长,则分子越稳定 |
| B、水分子可表示为H-O-H,分子中键角为180. |
| C、H-O键键能为463KJ/mol,即18gH2O分解成H2和O2时消耗能量为2×463KJ |
| D、元素周期表中的第ⅠA族和第ⅦA族元素的原子间可以形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Mg2+、SO42-、OH- |
| B、Na+、H+、Cl-、HCO3- |
| C、K+、Ag+、NO3-、Cl- |
| D、K+、Cu2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
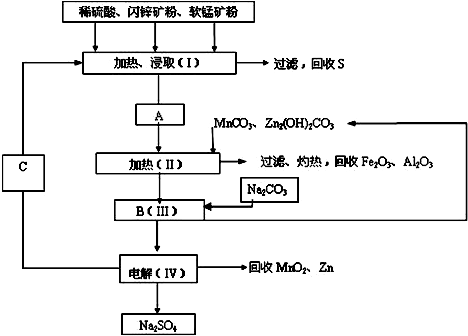
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com