
| A. |  氢气 氢气 | B. |  氨气 氨气 | C. |  水 水 | D. |  二氧化碳 二氧化碳 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

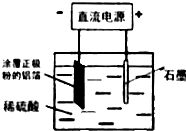
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 解释或结论 |
| A | 过量的铁粉中加入稀硝酸中,充分反应后,滴入KSCN溶液,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | AgI固体中滴入KCl溶液,沉淀由黄色变为白色 | AgI比AgCl难溶 |
| C | 铝箔插入稀硝酸中,无现象 | 铝箔表面被硝酸氧化,形成致密的氧化膜 |
| D | 苯酚溶液中滴加溴水,出现白色沉淀 | 苯酚易发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 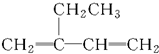 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | B. | CH2=CH-CH2-CH3 1-丁烯 | ||
| C. | 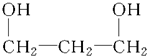 1,3-二丙醇 1,3-二丙醇 | D. | 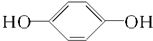 1,4-苯二酚 1,4-苯二酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯元素的相对原子质量为$\frac{12b}{a}$ | |
| B. | mg该氯原子的物质的量一定是$\frac{m}{(a{N}_{A})}$mol | |
| C. | 该氯元素的摩尔质量是aNA | |
| D. | ng该氯原子所含的电子数为$\frac{n}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,
将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com