
【题目】根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)最高正价为+1价,还能显﹣1价的元素是____(填元素符号);⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为________(填化学式).
(2)③的单质在空气中充分燃烧的化学方程式是________________________________.④与⑥形成的稳定化合物的电子式为______________.
(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为________________,其中含有的化学键类型为_________________.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈___色.⑤的最高价氧化物水化物的稀溶液与金属铜反应的离子方程式为______________________.
【答案】HNaOH>Mg(OH)2>Al(OH)34Li+O2![]() 2Li2O
2Li2O![]() NH4NO3离子键和共价键黄 3Cu+8H+ + 2NO3- === 3Cu2+ +2NO↑+4H2O
NH4NO3离子键和共价键黄 3Cu+8H+ + 2NO3- === 3Cu2+ +2NO↑+4H2O
【解析】
由元素在周期表的位置可以知道,①~⑩分别为H、He、Li、C、N、O、Na、Mg、Al、Cl,
(1)能显+1价,还能显-1价的元素位于IA族,金属无负价;金属性越强,对应高价氧化物对应的水化物的碱性越强;
(2)Li燃烧生成氧化锂;④与⑥形成的稳定化合物为二氧化碳;
(3)①、⑤、⑥三种元素形成的一种常见盐为硝酸铵;
(4)⑦与⑩形成的化合物为NaCl,焰色反应为元素的性质;稀硝酸与铜反应生成一氧化氮和硝酸铜。
(1)能显+1价,还能显-1价的元素位于IA族,金属无负价,则元素为H;金属性越强,对应高价氧化物对应的水化物的碱性越强,则⑦、⑧、⑨三种元素最高价氧化物对应的水化物分别为:NaOH、Mg(OH)2、Al(OH)3;所以碱性由强到弱的顺序排列为NaOH>Mg(OH)2>Al(OH)3 ;因此,本题正确答案是:H,NaOH>Mg(OH)2>Al(OH)3。
(2)Li燃烧生成氧化锂,方程式为4Li+O2![]() 2Li2O;④与⑥形成的稳定化合物为二氧化碳,为共价分子,碳氧原子间形成2对共用电子对,其电子式为
2Li2O;④与⑥形成的稳定化合物为二氧化碳,为共价分子,碳氧原子间形成2对共用电子对,其电子式为![]() ;因此本题答案是: 4Li+O2
;因此本题答案是: 4Li+O2![]() 2Li2O;
2Li2O; ![]() 。
。
(3)①、⑤、⑥三种元素形成的一种常见盐为硝酸铵,化学式为NH4NO3;它为离子化合物,含有离子键,同时氮原子与氢原子之间,氮原子和氧原子之间存在共价键;因此,本题答案是:NH4NO3,离子键和共价键。
(4)高温灼烧由⑦与⑩形成的化合物为NaCl,火焰呈黄色;⑤的最高价氧化物水化物的稀溶液为硝酸,与金属铜反应生成硝酸铜和一氧化氮,离子方程式为:3Cu+8H+ +2NO3- === 3Cu2+ +2NO↑+4H2O;综上所述,本题答案是:黄,3Cu+8H++2NO3- === 3Cu2++2NO↑+4H2O。


科目:高中化学 来源: 题型:
【题目】如图1是细胞中3种化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是

A. 若图1表示正常细胞,则元素中含量最多的是图2中的a
B. 若图1表示细胞完全脱水后化合物含量的扇形图,则A为蛋白质
C. 图2中数量最多的元素是碳元素,这与细胞中含量最多的化合物有关
D. 若图1表示正常细胞,则B化合物具有多样性,其必含的元素为C,H,O,N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E、F、G的原子序数依次增大,A、F原子的最外层电子数等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同的能级,且每个能级上排布的电子数相等;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F;G原子最外层有一个单电子,且内层原子轨道均排满。
(1)与C单质分子互为等电子体的分子为_____,该分子的电子式为______________。
(2)B、C、D三种元素第一电离能从大到小的顺序:________(填元素符号)
(3)光谱证实:单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在_________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
(4)B、C、D三种元素与A形成的最简单化合物的稳定性由强到弱的顺序:____(填化学式)
(5)G位于元素周期表的____区,向含有G2+离子的溶液中通入A、C形成的最简单分子至过量所涉及的两个离子方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有四种离子,已知其中三种离子Na+、Mg2+、NO3﹣的物质的量浓度分别为0.2molL﹣1 , 0.1molL﹣1 , 0.1molL﹣1 , 则溶液中另一离子及其物质的量浓度可能是( )
A.SO42﹣ 0.1 molL﹣1
B.Al3+ 0.2 molL﹣1
C.Cl﹣ 0.3 molL﹣1
D.K+ 0.4 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蜂胶是蜜蜂从植物芽孢或树干上采集的树脂。在蜂胶众多的功效成分中,咖啡酸苯乙酯(CAPE) 已经被鉴定为蜂胶中的主要活性组分之一。
已知:①A的核磁共振氢谱有三个波峰,红外光谱显示咖啡酸分子中存在碳碳双键。
②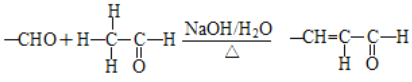
③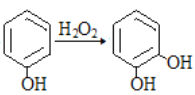
合成咖啡酸苯乙酯的路线设计如下:
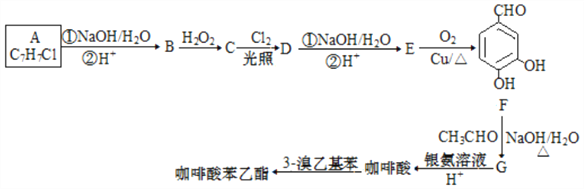
请回答下列各题:
(1)物质 A 的名称为________。
(2)由B生成C和C 生成 D 的反应类型分别是________、________。
(3)E 的结构简式为________。
(4)咖啡酸生成咖啡酸苯乙酯的化学方程式为________。
(5)芳香化合物X是G(C9H8O3)的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,且与新制 Cu(OH)2反应生成砖红色沉淀,其核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出两种符合要求的X的结构简式________。
(6) 参照上述合成路线,以丙醛和 为原料(其他试剂任选),设计制备
为原料(其他试剂任选),设计制备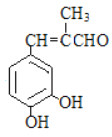 的合成路线______________________
的合成路线______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图是实验室制取和收集气体的常用装置:
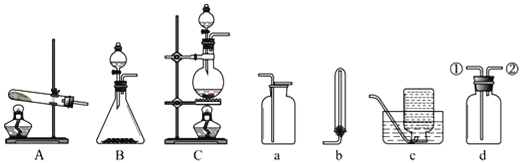
(1)用A装置制取氨气的化学方程式是___________________________________。若用B装置制取氨气,则选用的药品是________________________________。
(2)收集干燥氨气时,选用的干燥剂是___________________________________。
(3)图a、b、c、d是某学生设计的收集气体的几种装置.若用d装置收集氨气,则气体流向为___________(用序号说明).若要收集NO气体,则应选择______装置;
(4)若用C装置与d装置相连制取并收集X气体,则X可能是下列气体中的_____。
①CO2 ②NO ③Cl2 ④SO2 ⑤NH3
(5)按图装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是_______________________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是___________________________________________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A.能生成碱的金属元素都在ⅠA族
B.原子序数为114的元素位于元素周期表的第七周期ⅣA族
C.稀有气体元素原子的最外层电子数均为8
D.第ⅥA族元素的最高正价与最低负价的代数和为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为芳香族化合物,有如下转化关系:![]()
(1)有机物C的分子式为C8H10O2 , 核磁共振氢谱显示3组峰,C不能与NaOH反应,写出C的结构简式___ . 上述反应中属于取代反应的是___(填数字序号).
(2)写出反应②、③的化学方程式:___;___ .
(3)1mol D与足量的银氨溶液完全反应生成E,E是合成纤维涤纶的一种单体,另一种单体是C,写出合成涤纶的化学方程式___ .
(4)1mol E、F(F的式量小于E)完全燃烧,消耗O2的量相等,且1 mol F能和1mol NaOH完全反应,写出F的结构简式___ .
(5)G的分子式为C8H8O4 , 且知苯环上的一氯取代物只有两种,G不与NaHCO3反应,能与Na和NaOH反应,等质量的G消耗Na和NaOH的物质的量之比为2:3,则符合上述条件G的结构简式为___(写出一种).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“染色”馒头主要掺有违禁添加剂“柠檬黄”,过量食用对人体会造成很大危害。柠檬黄生产原料主要是对氨基苯磺酸及酒石酸,其结构简式如下,则下列有关说法正确的是( )
对氨基苯磺酸:![]() 酒石酸:
酒石酸:![]()
A. 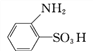 用系统命名法可命名为邻氨基苯磺酸
用系统命名法可命名为邻氨基苯磺酸
B. 对氨基苯磺酸、酒石酸都能发生加成反应和取代反应
C. 对氨基苯磺酸苯环上的一氯代物有4种
D. 1 mol酒石酸分别和足量钠、碳酸氢钠溶液反应,都能产生2 mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com