
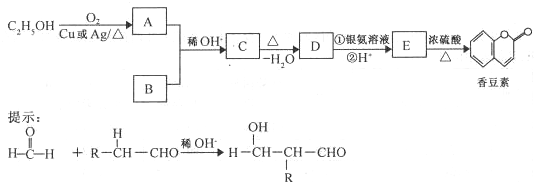
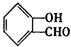
 ,则C为
,则C为 ,D为
,D为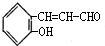 ,D与新制氢氧化铜在加热条件下氧化生成E为
,D与新制氢氧化铜在加热条件下氧化生成E为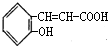 ,E发生分子内酯化反应生成
,E发生分子内酯化反应生成 ,据此解答;
,据此解答;| 酒化酶 |
| 酒化酶 |
 ,则C为
,则C为 ,D为
,D为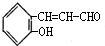 ,D与新制氢氧化铜在加热条件下氧化生成E为
,D与新制氢氧化铜在加热条件下氧化生成E为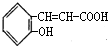 ,E发生分子内酯化反应生成
,E发生分子内酯化反应生成 ,
, ,含有的含氧官能团的名称为:醛基、羟基;D的结构简式是
,含有的含氧官能团的名称为:醛基、羟基;D的结构简式是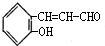 ;D→E中①是醛基被氧化,属于氧化反应,
;D→E中①是醛基被氧化,属于氧化反应,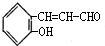 ;氧化反应;
;氧化反应;| Cu |
| △ |
 ,
,| Cu |
| △ |
 ;
; ,有多种同分异构体,其中苯环上只有一个侧链的所有同分异构体可为酸或酯,结构简式是
,有多种同分异构体,其中苯环上只有一个侧链的所有同分异构体可为酸或酯,结构简式是 ,故答案为:
,故答案为: ;
;| 6 |
| 4 |


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
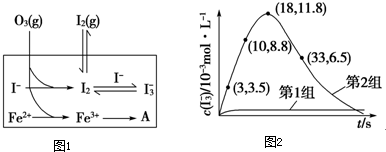
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
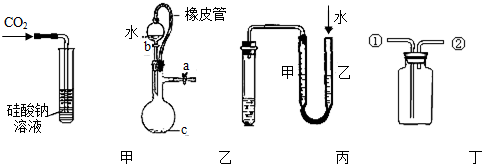
| A、甲装置:可用来证明碳的非金属性比硅强 |
| B、乙装置:橡皮管的作用是能使水顺利流下 |
| C、丙装置:用图示的方法不能检查此装置的气密性 |
| D、丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| CH |
| | |
| A、2种 | B、3种 | C、4种 | D、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
| B、Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C、向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W四种常见元素,且均为短周期元素.已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧.
X、Y、Z、W四种常见元素,且均为短周期元素.已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com