
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
分析 (1)根据溶液中强酸制弱酸的原理以及酸性越强电离平衡常数越大来回答;
(2)常温下0.1mol/LCH3COOH溶液加水稀释,c(H+)减小,c(OH-)增大,Kw不变,电离常数不变,据此分析;
(3)稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大.
解答 解:(1)根据溶液中强酸制弱酸的原理以及反应HA+HB-(少量)=A-+H2B,H2B(少量)+C-=HB-+HC,HA(少量)+C-=A-+HC,可以确定酸性强弱是:HA>H2B>HC>HB-,酸性越强,弱酸的电离平衡常数越大,
则:
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | 1.8×10-5 | 4.3×10-7 | 5.6×10-11 | 4.9×10-10 |
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | 1.8×10-5 | 4.3×10-7 | 5.6×10-11 | 4.9×10-10 |
点评 本题考查电离平衡常数及酸性的比较、pH与酸的稀释等知识,注意水解规律中越弱越水解和稀释中强的变化大来分析解答,综合性较大,题目难度中等,需要学生具备扎实的基础,以及较好的分析应用能力.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏罐贮运浓硫酸 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 次氯酸具有强氧化性,因此氯气可用于自来水的杀菌消毒 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
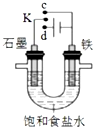
| A. | 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O | |
| B. | 若K与c连接,则溶液中的Na+向铁电极移动 | |
| C. | 若K与d连接,铁电极的电极反应为:2H++2e-═H2↑ | |
| D. | 若K与d连接,一段时间后,加适量稀盐酸可使电解质溶液复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
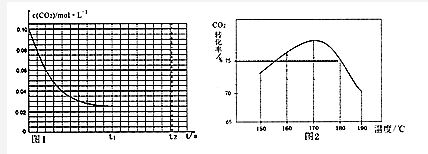
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小:X<Y,Z>W | |
| C. | 化合物Z2Y和ZWY3都只存在离子键 | |
| D. | Y,W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
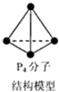
| A. | 常温常压下,16g 14CH4所含中子数目为8NA | |
| B. | 标准状况下,22.4 L CCl4所含分子数目为NA | |
| C. | 6.2g白磷(分子式为P4,分子结构如图所示)所含P-P键数目为0.3NA | |
| D. | 1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
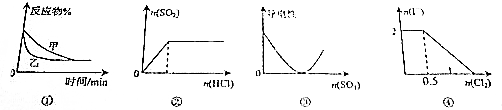
| A. | 图①表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| B. | 图②表示一定浓度的Na2SO3溶液中滴加稀盐酸,生成SO2与HCl的物质的量的关系 | |
| C. | 图③表示在Ba(OH)2溶液中加入SO3至过量的过程中溶液导电性的变化 | |
| D. | 图④表示在1L 1mol•L-1FeI2溶液中,通入Cl2时I-物质的量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H与3H互为同位素 | B. | 金刚石与石墨互为同素异形体 | ||
| C. | 3O2$\frac{\underline{\;放电\;}}{\;}$2O3是物理变化 | D. | 乙醇与二甲醚互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 在细菌作用下铜矿石可以直接转换为单质铜.这个过程叫作生物炼铜 | |
| D. | 天津港爆炸事件中参与燃烧的一种危险品“甲苯二异氰酸酯(TDI)”,该危险品属于芳香烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com