
| 消耗量 |
| 起始量 |
| 0.92 |
| 0.55×y |
| 0.45mol/L |
| 0.4795mol/L |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、1.2 mol |
| B、1.5 mol |
| C、1.8 mol |
| D、2.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用物质B表示反应的平均速率为0.3 mol?L-1?s-1 |
| B、2 s时气体密度与起始时气体密度之比为3:2 |
| C、2 s时物质A的转化率为70% |
| D、2 s时物质B的浓度为0.7 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
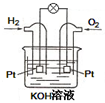 (1)已知:
(1)已知:查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
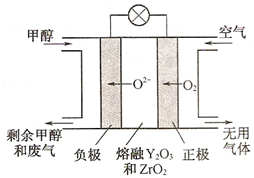
查看答案和解析>>
科目:高中化学 来源: 题型:
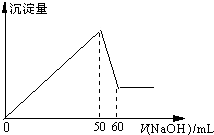 铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途.
铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com