
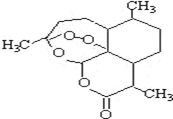
 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H22O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 该化合物中含有过氧键,一定条件下有氧化性 | |
| D. | 青蒿素易溶于水 |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c+n+m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
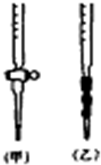 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
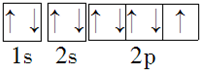 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com