
| A. | SiO2→Si | B. | SiO2→H2SiO3 | C. | Si→Na2SiO3 | D. | CO2→C |
分析 A.二氧化硅与焦炭在高温下生成硅和一氧化碳;
B.二氧化硅不溶于水,不能与水反应;
C.硅与氢氧化钠反应生成硅酸钠和氢气;
D.二氧化碳与镁反应生成氧化镁与碳;
解答 解:A.二氧化硅和碳高温反应制得粗硅,反应方程式为:SiO 2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO,所以能实现一步转化,故A不选;
B.二氧化硅和水不反应,所以由二氧化硅生成硅酸不能实现一步转化,一般是先用二氧化硅和氢氧化钠反应制取硅酸钠,再用硅酸钠和盐酸反应制取硅酸,故B选;
C.硅和氢氧化钠反应生成硅酸钠,反应方程式为:Si+2NaOH+H 2O═Na 2SiO 3+2H 2↑,所以能实现一步转化,故C不选;
D.镁在二氧化碳中燃烧生成碳单质,反应方程式为CO 2+2Mg $\frac{\underline{\;点燃\;}}{\;}$2MgO+C所以能实现一步转化,故D不选;
故选B.
点评 本题考查了物质的转化,明确物质的性质及发生反应是解题关键,注意镁能在二氧化碳中燃烧,题目难度不大.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:解答题
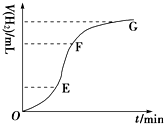 现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:
现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
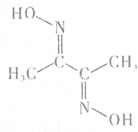 铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:
铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应,一定是吸收能量的反应 | |
| B. | 在化学反应过程中总是伴随着能量的变化 | |
| C. | 释放能量的反应在常温下一定很容易发生 | |
| D. | 在确定的化学反应中反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2b-c | B. | a+b-2c | C. | 2a+2b-c | D. | a+2b-2c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
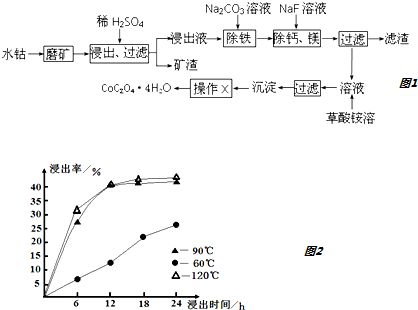
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
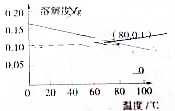
| A. | 熟石灰的溶解是吸热过程 | |
| B. | 温度升高时熟石灰的熔解速率减慢 | |
| C. | 80℃时,熟石灰的Ksp约等于9.8×10-6 | |
| D. | 若硝酸钾中含有少量的熟石灰,可用溶解、过滤的方法进行提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com