
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是
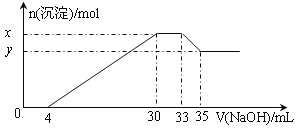
A. X与Y的差值为0.01 mol
B. 原溶液中c(Cl-)=0.66mol·L-1
C. 原溶液的c(H+)=0.8 mol·L-1
D. 原溶液中n(Mg2+)∶n(Al3+)=10∶1
【答案】B
【解析】根据阳离子离子结合OH-的能力可知,氢氧化钠首先中和的是氢离子,则消耗氢氧化钠是4mL,然后与金属阳离子反应生成白色沉淀,最后与NH4+反应,消耗氢氧化钠是3mL。根据图像可知,溶解氢氧化铝消耗氢氧化钠是2mL,则生成氢氧化铝消耗氢氧化钠是6mL,所以生成氢氧化镁消耗的氢氧化钠是20mL,因此Mg2+、Al3+、NH4+、H+的物质的量分别是0.04mol、0.008mol、0.012mol、0.016mol,所以氯离子的物质的量是0.04mol×2+0.008mol×3+0.012mol+0.016mol=0.132mol,浓度是0.66mol/L,氢离子浓度是0.08mol/L,所以A. X与Y的差值为0.008 mol,选项A错误;B. 原溶液中c(Cl-)=0.66mol·L-1,选项B正确;C. 原溶液的c(H+)=0.08 mol·L-1,选项C错误;D. 原溶液中n(Mg2+)∶n(Al3+)=0.04mol:0.008mol =5∶1,选项D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
A.只存在于氧气中
B.只存在于SO3中
C.只存在于SO2和SO3中
D.SO2、SO3、O2中都存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(夹持装置略,气密性已检验)如图所示。下列推断不合理的是

A. B中收集到的气体是氢气
B. 烧杯中双氧水溶液的作用是将Fe2+ 氧化为Fe3+
C. A中存在氧化铁与盐酸反应生成氯化铁的反应
D. 向反应后的烧杯中通入少量SO2,溶液颜色将立即由棕黄色变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机实验操作或叙述正确的是( )
A.将乙烯和乙炔气体分别通入溴的四氯化碳溶液中,两者都褪色
B.甲烷和氯气在室温下的光照环境中可以稳定存在
C.苯能使溴水褪色是因为二者反应生成了溴苯
D.要除去乙烷中的乙烯制得纯净的乙烷,将混合气体通入酸性高锰酸钾溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定温度下的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g),已知c(SO2)=0.4mol/L,c(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19,试判断:
(1)当SO2的转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?
(2)达平衡状态时,SO2的转化率应为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( ) 
A.将茶叶灼烧灰化,选用②、④和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+ , 选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由FeO、Fe2O3和Fe3O4组成的混合物,测得其铁元素与氧元素的质量比为21∶8,
则混合物中FeO、Fe2O3和Fe3O4的物质的量之比可能是( )
A. 1∶2∶1 B. 2∶1∶1 C. 1∶1∶1 D. 2∶3∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com