
苹果酸是一种常见的有机酸,其结构简式如下图。苹果酸可能发生的反应是 ( )
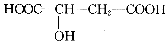
①NaOH溶液反应
②使石蕊溶液变红
③与金属钠反应放出气体
④一定条件下与乙酸发生酯化反应
⑤一定条件下与乙醇发生酯化反应
A.①②③ B.①②③④ C.①②③⑤ D.①②③④⑤
科目:高中化学 来源:2015-2016学年宁夏高二下学期期中考试化学试卷(解析版) 题型:填空题
根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物为________(填两种化合物的化学式);
(2)属于稀有气体的是________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是________;
(4)第三周期中,原子半径最大的是(稀有气体除外)________;
(5)推测Si、N最简单氢化物的稳定性:________强于________(填化学式)。
(6)电负性最大的元素是________,电负性最小的元素是________。
(7)原子中p轨道半充满的元素是________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A、向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离可除去乙酸乙酯中的少量乙酸
B、用溴水可鉴别苯、乙醇、四氯化碳
C、乙烯和苯都能使溴水褪色,褪色的原理相同
D、有些油脂不能使溴的四氯化碳溶液褪色[来
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末文科化学A卷(解析版) 题型:选择题
根据元素在周期表中的位置判断,下列元素中原子半径最小的是( )
A. 氧 B. 氮 C. 碳 D. 氟
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:填空题
Ⅰ.某温度下,在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:
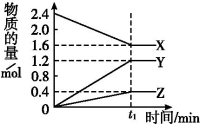
(1)该反应的化学方程式是  。
。
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为 ;在此t1 min时间内,用H2表示反应的平均速率v(H2)为 。
Ⅱ.亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
Na2SO3+KIO3+H2SO4 = N a2SO4+K2SO4+I2+H2O
a2SO4+K2SO4+I2+H2O ,
,
该反应过程和 机理
机理 较复杂,一般认为分为以下几步:
较复杂,一般认为分为以下几步:
IO3-+SO32-→IO2-+SO42-(慢)②IO2-+ SO32-→IO-+SO42-(快)
③5I-+6H++ IO3-→3I2+3H2O(快)④I2+ SO32-+ H2O→2I-+ SO42-+2H2(快)
(1)根据上述条件推测,此反应的总的反应速率由 步反应决定。
(2)若预先加入淀粉溶液,由题述看必在 离子消耗完时,才会使淀粉谈蓝的现象产生。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
利用金属活性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是 ( )
 A.2Al2O3(熔融)
A.2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
B.Fe2O3+3CO  2Fe+3CO2
2Fe+3CO2
C.Fe+CuSO4 ===FeSO4+Cu
D.2KCl(水溶液) 2K+Cl2↑
2K+Cl2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
四川有丰富的天然气资源。天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体。 下列有关说法不正确的是( )
下列有关说法不正确的是( )
A.甲烷与丙烷互为同系物
B.甲烷是烃类物质中氢的质量分数最高的化合物
C.甲烷、乙烷、丙烷中的化学键都是 极性共价键
极性共价键
D.乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下热身考理综化学试卷(解析版) 题型:填空题
物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____________,1mol (C2H5O)3P=O分子中含有的σ键与π键的数目比为__________________。
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:
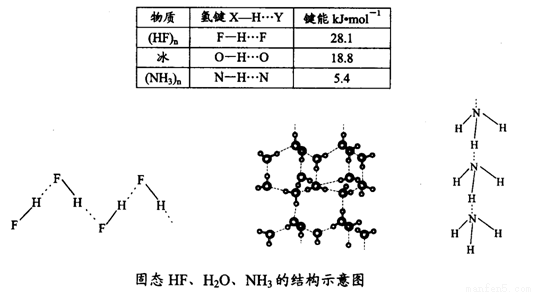
解释H2O、HF、NH3沸点依次降低的原因___________________。
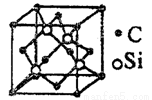
(5)碳化硅的结构与金刚石类似(如图所示),其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________个,与碳原子等距离最近的碳原子有__________个。已知碳化硅晶胞边长为a pm,则碳化硅的密度为__________g·cm3。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春十一高三下考前冲刺理综化学试卷二(解析版) 题型:简答题
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
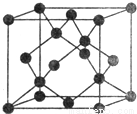
(1)Q+核外电子排布式为___________;
(2)化合物X2W2中W的杂化方式为___________,ZW2-离子的立体构型是___________;
(3)Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com