
分析 二价铁离子、溴离子都具有还原性,二价铁离子还原性强于溴离子,氯气少量只氧化二价铁离子;
氯气过量二价铁离子、溴离子都被氧化;与等量的氯气反应,溴离子部分被氧化.
解答 解:二价铁离子、溴离子都具有还原性,二价铁离子还原性强于溴离子,氯气少量只氧化二价铁离子,离子方程式:2Fe2++Cl2=2Fe3++2Cl-;
氯气过量二价铁离子、溴离子都被氧化,离子方程式:2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl-;与等量的氯气反应,溴离子部分被氧化,离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl-.
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl-;
2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl-.
点评 本题以氯气和溴化亚铁的反应为载体考查了氧化还原反应,明确溶液中离子反应的先后顺序是解本题的关键,题目难度中等.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
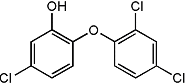 三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )| A. | 物质的分子式为C12H7Cl3O2 | |
| B. | 该物质苯环上的一溴取代物有6种 | |
| C. | 该物质中含有四种官能团 | |
| D. | 该物质中所有原子都可能处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO2)2溶液中加入过量NaOH溶液Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 酸性条件下KIO3溶液与KI溶液反应IO${\;}_{3}^{-}$+5I-+3H2O═3I2+6OH- | |
| C. | AlCl3溶液中加入少量Na 2Al3++6Na+6H2O═2Al(OH)3↓+6Na++3H2↑ | |
| D. | FeBr2溶液中通入少量Cl2 2Fe2++4Br+3Cl2→2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
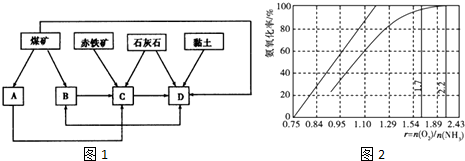
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
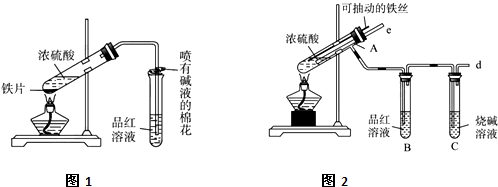
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
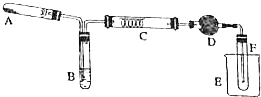 某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)
某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
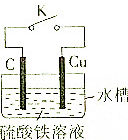 某同学为了探究原电池原理,设计如图所示装置:
某同学为了探究原电池原理,设计如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(Na+)>c(H+)>c(HC2O4- )>c(C2O42-)>c(OH-) | |
| B. | V(NaOH)=5 mL时,c(Na+)═c(C2O42-)+c(HC2O4- )+c(H2C2O4) | |
| C. | V(NaOH)=10 mL时,c(Na+)═c(HC2O4-)+c(C2O42-) | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com