
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
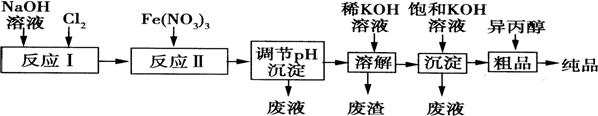
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整
pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
|
| A. | 电池工作时,锌失去电子 |
|
| B. | MnO2为该电池的负极 |
|
| C. | 正极反应为:Zn﹣2e﹣=Zn2+ |
|
| D. | 该电池放电时化学能转换为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式书写正确的是( )
|
| A. | NaHCO3=Na++H++CO32﹣ | B. | HF⇌H++F﹣ |
|
| C. | H2CO3⇌2H++CO32﹣ | D. | CH3COONH4⇌CH3COO﹣+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
今有①盐酸、②醋酸、③硫酸三种稀溶液,用序号回答下列问题.
(1)若三种酸的物质的量浓度相等.
a.三种溶液中的c(H+)大小关系为 .
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为 .
(2)若三种酸溶液中的c(H+)相等.
a.三种酸的物质的量浓度大小关系为 .
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
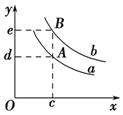
下列图示与对应的叙述相符的是( )


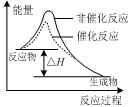
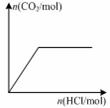
图甲 图乙 图丙 图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.每一周期的元素都是从碱金属开始,最后以稀有气体结束
B.同一周期中(除第一周期外),从左到右,各元素原子核的电子数都是从1个逐渐增加到8个
C.第二、三周期上下相邻元素的原子核外电子数相差8个
D.第七周期只有23种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种叙述中,正确的是 ( )
①Cl-和Cl2的性质相同;②ClO3-具有氧化性;③Cl-比Cl多一个电子;④Cl-具有酸性; ⑤盐酸兼有酸性、氧化性、还原性; ⑥Cl2的氧化性比盐酸的强;⑦Cl2只有氧化性而没有还原性
A.①②⑤⑥ B. ①②④⑥
C. ②③⑤⑥ D. ②③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
CH3COONa溶液中存在水解平衡:CH3COO-+H2OCH3COOH+OH-,下列说法正确的是 ( )。
A.加入少量NaOH固体,c(CH3COO-)减小
B.加入少量FeCl3固体,c(CH3COO-)减小
C.稀释溶液,溶液的pH增大
D.加入适量的醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3 的反应:3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
(1)从反应开始到平衡,v(SiCl4)= 。
(2)该反应的平衡常数表达式为K= ,温度升高,K值增大,则Q 0(填“>”、“<”或“=”)。
 (3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为 。
(5)平衡后,将容器的体积缩为10 L,再次达到平衡时,
H2的物质的量浓度范围为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com